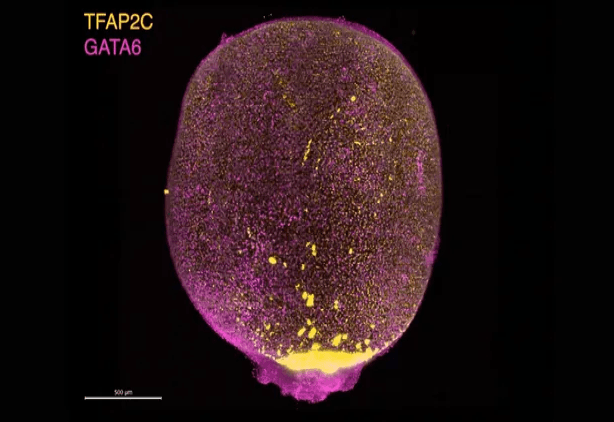
Investigadores han desarrollado un nuevo modelo de laboratorio a partir de células madre que replica el saco amniótico humano en las primeras dos a cuatro semanas después de la fertilización. La estructura, que según los investigadores es el modelo amniótico más avanzado y maduro jamás creado, podría ofrecer nuevos conocimientos sobre el desarrollo humano y conducir a productos celulares para procedimientos médicos, desde tratamientos de quemaduras hasta la reconstrucción de la córnea, informó el equipo en un estudio publicado el 10 de julio en la revista Cell.
El embrión humano en crecimiento no está solo en su camino hacia el desarrollo. “Los tejidos de soporte, como la placenta y el saco amniótico, crecen con el embrión y son fundamentales para su crecimiento y supervivencia”, afirmó Silvia Santos, coautora del estudio y líder del grupo en el Instituto Francis Crick de Londres.
El saco amniótico es un globo biológico lleno de líquido que amortigua y protege al embrión en crecimiento. Se cree que el líquido que contiene es esencial para el desarrollo embrionario sano. Sin embargo, no ha sido fácil investigar esta interacción entre el embrión y su entorno, en gran medida porque estudiar esta etapa del desarrollo en seres humanos es logísticamente difícil y éticamente complejo.
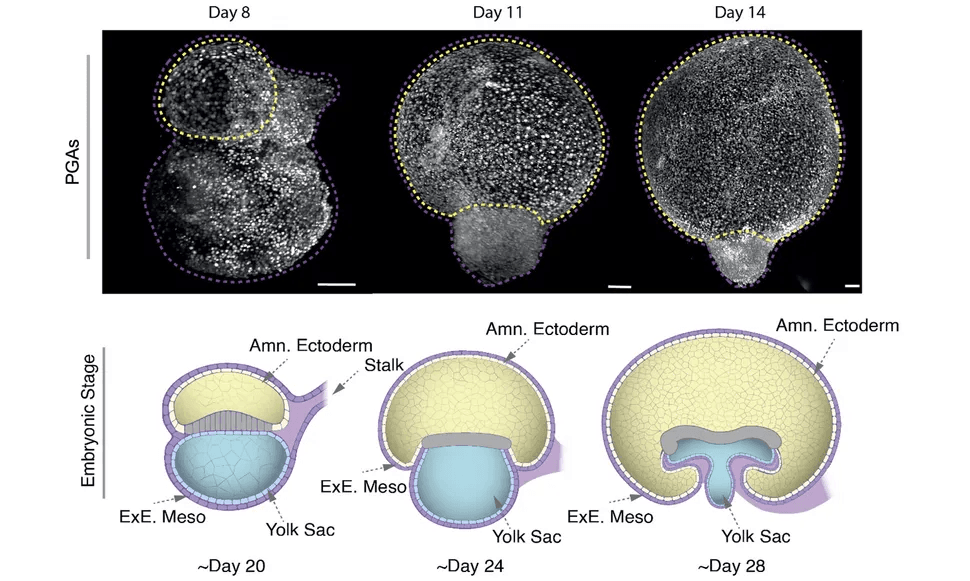
Los intentos previos de modelar el saco amniótico en el laboratorio no lograron replicar su compleja estructura tridimensional, que consta de dos capas celulares distintas. Además, los modelos anteriores tendían a durar solo unos días, lo que dificultaba comprender el extenso proceso de desarrollo.
En cambio, los nuevos modelos celulares de Santos, llamados amnioides posgastrulacionales (PGA), pueden sobrevivir en sus placas de laboratorio durante al menos tres meses y desarrollarse al mismo ritmo que un saco amniótico de un mes. Sorprendentemente, también alcanzan un tamaño similar: hasta aproximadamente 2,5 centímetros.
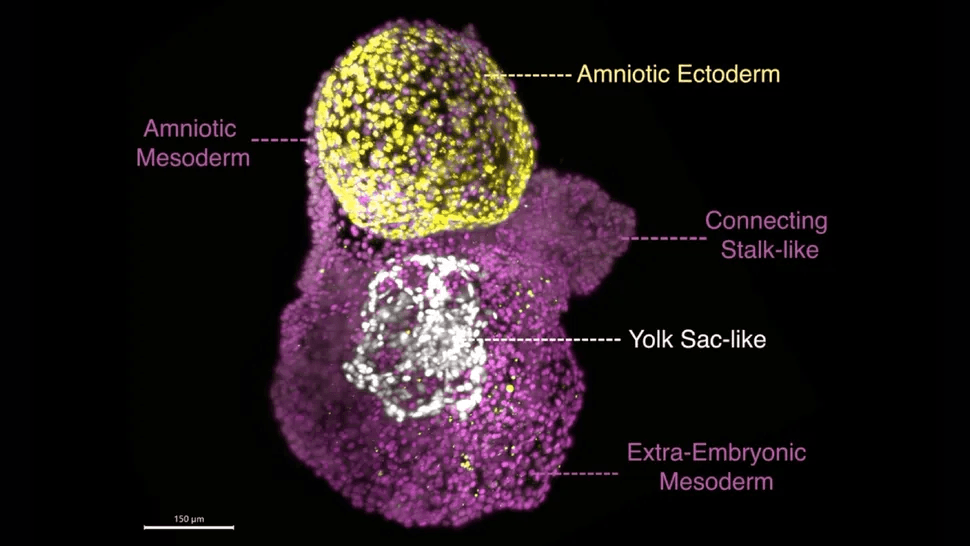
“Son pequeñas pelotas de golf”, explicó Santos a Live Science. Las PGA también forman la distintiva estructura de dos capas del saco amniótico.
Para lograrlo, el equipo de Santos empleó un nuevo método de cultivo celular. Comenzaron con células madre embrionarias, que pueden crecer y convertirse en cualquier otro tipo de célula del cuerpo si se les estimula con moléculas de señalización específicas. El equipo expuso estas células a dos de estas señales, llamadas BMP4 y CHIR. Se aseguraron de espaciar las señales, añadiendo BMP4 durante las primeras 24 horas de crecimiento, seguida de CHIR durante otras 24 horas.
Luego, los investigadores dejaron las células en placas de cultivo de fondo redondo. “El resto fue una autoorganización completa”, lo que significa que las células madre en maduración orquestaron su propio ensamblaje para formar una estructura, explicó Santos.
Las células individuales se agregaron en las placas y formaron la distintiva estructura de dos capas, llena de líquido, que el equipo buscaba. “Esto demuestra que estas células madre embrionarias tienen una asombrosa propensión a especializarse y a convertirse en todo si reciben las instrucciones correctas, algo que todavía me asombra”, dijo Santos.
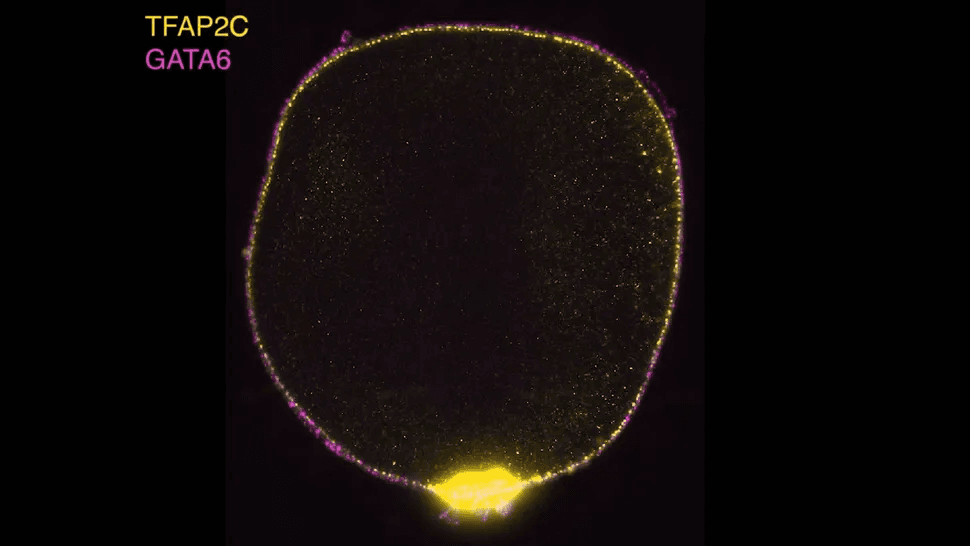
Con sus nuevos modelos, el equipo se propuso responder preguntas clave sobre cómo los sacos amnióticos influyen en su entorno. Querían saber qué genes podrían estar dirigiendo la transformación de las células en PGA. Al interferir con una larga lista de genes que sospechaban que podrían influir en el desarrollo celular, descubrieron que un solo gen, GATA3, podía convertir las células en sacos amnióticos sin ninguna otra señal.
GATA3 codifica un factor de transcripción, una proteína que activa o desactiva otros genes. Santos y su equipo demostraron que dos de los genes que regula GATA3 son BMP4 y CHIR, los mismos genes que su protocolo de cultivo había involucrado.
Para explorar cómo el saco amniótico puede influir en las células cercanas, mezclaron sus PGA con células madre adicionales que no habían sido estimuladas para convertirse en ningún tipo celular en particular. De haber permanecido solas, estas células habrían continuado existiendo en su estado no especializado. Pero junto a las PGA, se transformaron en una serie de otros tipos de células “extraembrionarias”, lo que demuestra que el saco amniótico era capaz de impulsar la transformación de las células a su alrededor.
Santos y su equipo están explorando posibles aplicaciones para su nuevo sistema. Los sacos amnióticos poseen propiedades antimicrobianas y antiinflamatorias, y las personas que se han sometido a cesáreas programadas pueden donarlos para su uso como tejido de trasplante en tratamientos de quemaduras o reparaciones de córnea. Estos materiales donados pueden ser difíciles de estandarizar, explicó Santos, pero, en teoría, los PGA podrían proporcionar una fuente confiable de estas células deseadas.
Yi Zheng, profesor adjunto de ingeniería biomédica y química en la Universidad de Siracusa, Nueva York, que no participó en el estudio, dijo que se requerirían más pruebas para ver si los PGA podrían proporcionar materiales clínicamente útiles para tales procedimientos. Añadió que las células maduras no madre pueden transformarse de nuevo en células madre llamadas células madre pluripotentes inducidas (iPSC). Zheng afirmó que las iPSC convertidas en PGA podrían ser particularmente útiles para aplicaciones médicas, en parte porque se podrían utilizar las propias células del paciente para generarlas.
Mejores modelos del saco amniótico también podrían ayudar a los investigadores a comprender por qué esta estructura crítica a veces funciona mal. Algunos trastornos congénitos (es decir, aquellos con los que nacen los bebés) se relacionan con diferencias en el tamaño o el contenido del saco amniótico antes del nacimiento, y Santos afirmó que los estudios de viabilidad genética (PGA) podrían ayudar a explicar esta relación.
“Estoy sumamente entusiasmada con el potencial de estas pequeñas estructuras”, concluyó.
Fuente: Live Science.