El agua puede parecer aburrida, pero es mucho más extraña de lo que parece. Científicos japoneses han demostrado que, confinadas en espacios reducidos, las moléculas de agua pueden comportarse como un sólido y un líquido simultáneamente.
Las diferencias entre el agua líquida y el hielo que experimentamos a escala macro comienzan en la micro. En el hielo, las moléculas están encerradas en estructuras rígidas, mientras que en el agua flotan libremente, formando y rompiendo enlaces constantemente.

En el peculiar estado descrito en el nuevo artículo, las moléculas hacen ambas cosas. Se mantienen en una posición fija, como el hielo, pero giran rápidamente como lo harían en un líquido. Conocido como estado de prefusión, esta condición no había podido ser estudiada con anterioridad.
“El estado de prefusión implica la fusión del H2O con enlaces de hidrógeno incompletos antes de que la estructura de hielo completamente congelada comience a derretirse durante el proceso de calentamiento”, dice Makoto Tadokoro, químico de la Universidad de Ciencias de Tokio.
“Se trata en resumen de una nueva fase del agua en la que coexisten capas de H2O congelada y H2O en lento movimiento”.
Observar este extraño estado requirió un complejo experimento. Para empezar, el agua no era exactamente del tipo al que estamos acostumbrados en la vida cotidiana: se trata de lo que se conoce como “agua pesada”, donde los átomos de hidrógeno se sustituyen por deuterio, un isótopo del hidrógeno que contiene un neutrón en su núcleo.
Este “D₂O” se confinó entonces en un espacio extremadamente reducido, donde emergen todo tipo de comportamientos exóticos. Los investigadores crearon cristales en forma de bastón con diminutos canales hidrófilos de tan solo 1,6 nanómetros de ancho, congelaron el agua pesada que contenían y los recalentaron lentamente.
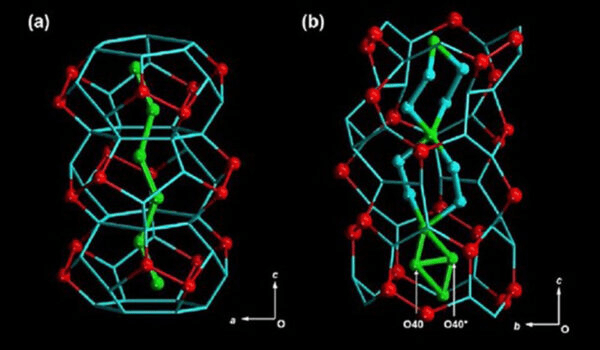
Finalmente, observaron todo el proceso mediante espectroscopia de resonancia magnética nuclear (RMN) estática de deuterio en estado sólido. Esto reveló que las moléculas formaban una estructura jerárquica de tres capas, con diferentes tipos de movimientos e interacciones en cada capa.
El estado de prefusión probablemente nos resulte más familiar como una fina película de agua que se forma sobre la superficie del hielo, incluso si las temperaturas aún están por debajo del punto de congelación. Sin embargo, ocurre de forma diferente en ese hielo masivo que en condiciones de confinamiento extremo.

Ya se sabe que el agua puede presentar comportamientos extraños cuando está confinada a escala nanométrica. Sus propiedades eléctricas pueden cambiar; puede volverse “incongelable” incluso a temperaturas cercanas al cero absoluto, o puede congelarse a temperaturas que deberían hacerla hervir. Aprovechar estas peculiaridades también podría tener usos prácticos, afirma el equipo.
“Al crear nuevas estructuras de redes de hielo, podría ser posible almacenar gases energéticos como hidrógeno y metano y desarrollar materiales a base de agua como hidratos de gas artificiales”, afirma Tadokoro.
La investigación fue publicada en el Journal of the American Chemical Society.
Fuente: Science Alert.

