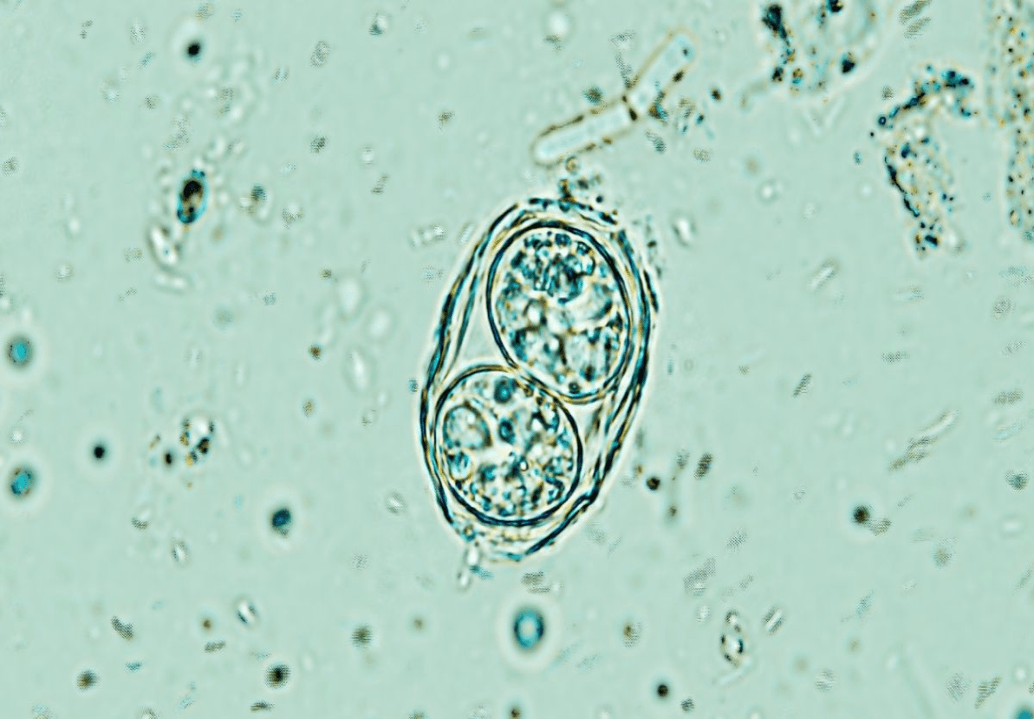
Hay un parásito viviendo en el cerebro de 40 millones de estadounidenses, y la mayoría de estos huéspedes humanos no lo saben en absoluto. Los médicos no suelen tratar este parásito a menos que empiece a causar estragos en los cuerpos de pacientes con sistemas inmunes debilitados, pero un nuevo descubrimiento puede acabar rápidamente con el invasor sin los riesgos típicos. El parasitólogo Rajshekhar Gaji dirige un laboratorio en la Facultad de Medicina Veterinaria de Virginia-Maryland, donde investiga qué es lo que hace que el parásito Toxoplasma gondii funcione.
“El parásito que reside en el cerebro se reactiva, empieza a multiplicarse y resulta mortal”, explica Gaji. “Por eso, el parásito es un patógeno temido”.
T. gondii está estrechamente asociado con los gatos, los únicos huéspedes conocidos donde el parásito puede reproducirse sexualmente. Sin embargo, una vez que sus crías se excretan en las heces del gato, hay muy pocas especies de sangre caliente en las que T. gondii no se establezca.
Para la mayoría de nosotros, una infección por T. gondii pasará completamente desapercibida. Para quienes padecen cáncer, VIH o toman inmunosupresores, el parásito presenta riesgos significativos.
Sin un sistema inmunológico saludable para mantener a raya al T. gondii, estos pacientes pueden desarrollar rápidamente una enfermedad conocida como toxoplasmosis, que puede provocar síntomas parecidos a la gripe, inflamación de los ganglios linfáticos e inflamación del cerebro. El parásito también puede transmitirse a la placenta del feto en desarrollo durante el embarazo. Esta forma de la enfermedad, la toxoplasmosis congénita, puede causar problemas de desarrollo e incluso abortos espontáneos.
Los tratamientos para la toxoplasmosis aguda incluyen medicamentos que actúan sobre mecanismos del parásito que son biológicamente similares a los procesos de nuestro propio organismo. Esto suele exponer a los pacientes al riesgo de sufrir efectos secundarios graves, restringiendo los tratamientos a situaciones donde las infecciones se consideran graves. Sin embargo, Gaji y su equipo podrían haber encontrado una pista: en un nuevo estudio, han demostrado que desactivar una sola proteína dentro del parásito microscópico puede matarlo.
La proteína TgAP2X-7 parece ser esencial para la capacidad del parásito de invadir un huésped, formar placas y autorreplicarse. Para demostrarlo, el equipo modificó genéticamente algunos parásitos para que sus proteínas TgAP2X-7 funcionen con normalidad a menos que se les añada auxina (una hormona vegetal que regula el crecimiento), en cuyo caso las proteínas se degradarían rápidamente.
La auxina, habían establecido previamente, no tenía impacto en el crecimiento de T. gondii o en la formación de placa por sí sola, por lo que cualquier efecto que tuviera sobre los parásitos modificados genéticamente podría atribuirse al hecho de que las proteínas TgAP2X-7 habían sido destruidas. Privados de TgAP2X-7, los parásitos no pudieron formar placas y su capacidad de invadir huéspedes (que, en este estudio de laboratorio, eran células de prepucio humano) se vio gravemente afectada.
Normalmente, tienen una tasa de éxito cercana al 100% al invadir este tipo de células, pero sin esa proteína clave, el éxito se redujo a menos del 50%. Además, les costó replicarse.
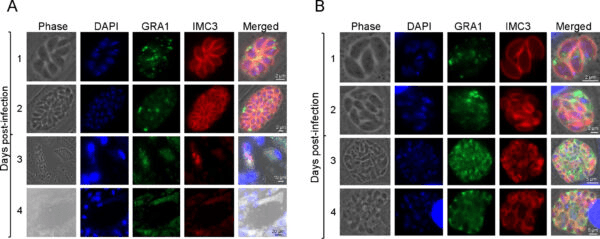
“Estos parásitos dejan de crecer por completo y no pueden sobrevivir”, afirma Gaji. “Esto demuestra que este factor de transcripción en particular es esencial para que el parásito sobreviva dentro del huésped”.
Lo mejor de todo es que esta proteína no se parece en nada a nada del cuerpo humano, lo que significa que existe el potencial de atacarla sin dañar a los pacientes.
“Existe una necesidad crítica de identificar y desarrollar nuevas opciones terapéuticas para tratar las infecciones por Toxoplasma”, escriben la primera autora, la parasitóloga Padmaja Mandadi, y su equipo.
“Los factores de transcripción únicos que regulan la expresión de proteínas involucradas en estos eventos del ciclo lítico podrían abrir nuevas oportunidades para intervenciones terapéuticas”.
Dado que gran parte del daño causado por T. gondii proviene de ciclos repetidos de invasión, replicación y destrucción celular, saber cómo interrumpir estos ciclos podría conducir a nuevas formas de tratar la enfermedad.
Esta investigación fue publicada en mSphere.
Fuente: Science Alert.