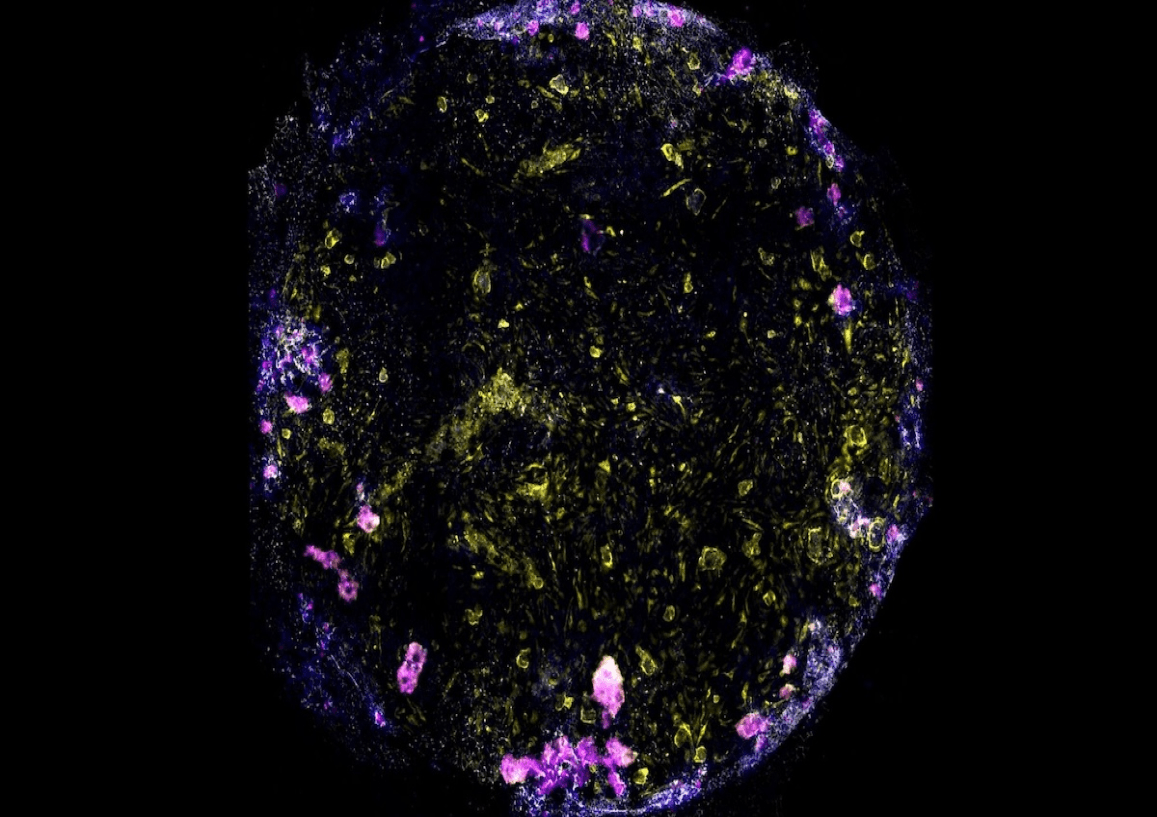
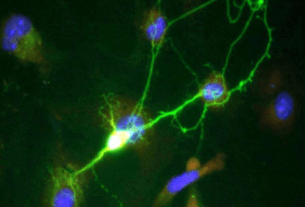
La tuberculosis ha plagado a la humanidad durante miles de años, y a pesar de los avances médicos que ahora pueden ayudarnos a prevenirla y curarla, la antigua enfermedad bacteriana todavía se cobra más vidas humanas por año que cualquier otro patógeno infeccioso. En un nuevo estudio, los investigadores revelan un dispositivo destinado a desmitificar las primeras etapas de la tuberculosis, incluido un retraso peculiar que a menudo precede a la aparición de los síntomas.
Su modelo también podría revelar cómo las variaciones genéticas en los pacientes conducen a distintos efectos de la tuberculosis, con implicaciones potencialmente amplias para la medicina personalizada. Aproximadamente una cuarta parte de nuestra especie está infectada con la bacteria de la tuberculosis, y aunque sólo una fracción de esas personas se enfermará, eso todavía equivale a más de 10 millones de casos nuevos –y más de 1 millón de muertes– por año en todo el mundo.
La tuberculosis progresa lentamente, y los síntomas suelen tardar meses en aparecer. Para comprender mejor este retraso, los autores se centraron en los diminutos sacos de aire de los pulmones, los alvéolos pulmonares, que albergan enfrentamientos cruciales entre las células inmunitarias y las bacterias.
“Los sacos de aire de los pulmones son una primera barrera fundamental contra las infecciones en los seres humanos, pero tradicionalmente los hemos observado en animales como los ratones”, dice el coautor Max Gutiérrez, quien dirige el Laboratorio de Interacciones Huésped-Patógeno en la Tuberculosis en el Instituto Francis Crick.
“Estos estudios son fundamentales para nuestra comprensión, pero los animales y los humanos tienen diferencias en la composición de las células inmunes y la progresión de la enfermedad, lo que despierta el interés en tecnologías alternativas”, dice Gutiérrez.
La tecnología emergente de “órgano en chip“, por ejemplo, permite a los científicos simular un órgano humano completo dentro de un microchip de cultivo celular microfluídico, ofreciendo una alternativa a los modelos animales. Ya existen algunos sistemas de “pulmón en un chip”, pero las limitaciones de esos modelos inspiraron a Gutiérrez y sus colegas a probar un enfoque diferente.
“Hasta ahora, los dispositivos de pulmón en chip se han fabricado con una mezcla de células derivadas del paciente y células disponibles comercialmente”, afirma Gutiérrez. “Esto significa que no pueden recrear completamente la función pulmonar ni la progresión de la enfermedad de un solo individuo, ya que cada tipo de célula es genéticamente diferente”.
En lugar de eso, los investigadores desarrollaron un nuevo pulmón en un chip para su estudio, que utiliza únicamente células genéticamente idénticas derivadas de una única célula madre humana.
“Utilizamos células madre pluripotentes inducidas humanas, que pueden convertirse virtualmente en cualquier célula del cuerpo, para producir células epiteliales alveolares tipo I y II”, dice el primer autor Jakson Luk, investigador postdoctoral en el laboratorio de Gutiérrez.
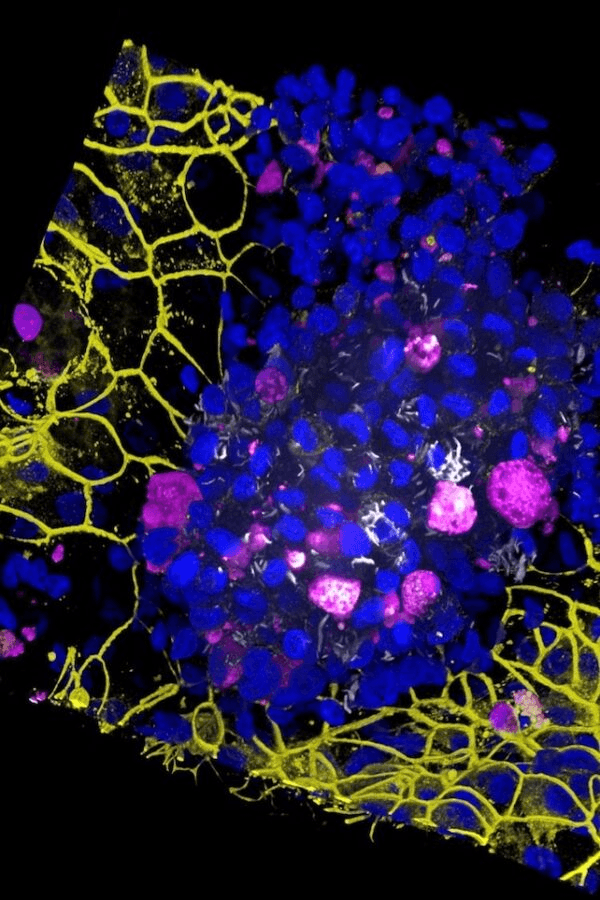
“Estas se cultivan en la parte superior de la membrana”, añade. “Utilizando las mismas células madre, también producimos células endoteliales vasculares que se cultivan en la parte inferior de la membrana”.
Esto ofreció una perspectiva novedosa del período de “caja negra” de la tuberculosis, o el tiempo transcurrido entre la infección inicial de una persona y la aparición de los síntomas.
“Queríamos buscar características de la enfermedad que se han reportado en pacientes en estudios clínicos y con animales”, dice Luk.
Cuando los investigadores agregaron células inmunes llamadas macrófagos al chip antes de introducir la tuberculosis, pronto notaron grupos de macrófagos con “núcleos necróticos”: un grupo central de macrófagos muertos anidado en un grupo más grande de macrófagos vivos.
“Finalmente, cinco días después de la infección, las barreras de las células endoteliales y epiteliales colapsaron, lo que demuestra que la función del saco aéreo se había deteriorado”, afirma Luk.
Sin embargo, no todos los pulmones reaccionan a la tuberculosis de la misma manera, por lo que los investigadores también buscaron aprender cómo las diferencias genéticas pueden conducir a respuestas variables.
“Eliminamos el gen ATG14, que participa en un proceso natural de degradación de células dañadas y materiales extraños”, afirma Luk.
“Los macrófagos que carecían de este gen eran más susceptibles a la muerte celular en condiciones de reposo, e intentaban engullir más bacterias de la tuberculosis cuando se infectaban, lo que confirma el papel del gen en mantener intactas nuestras defensas inmunológicas”, explica.
Se necesitará más investigación, pero Luk y sus colegas ven su chip como un paso clave hacia un tratamiento más personalizado de la tuberculosis y otras infecciones también.
“Ahora podríamos construir chips a partir de personas con mutaciones genéticas particulares para comprender cómo las infecciones como la tuberculosis les afectarán y probar la efectividad de tratamientos como los antibióticos”, dice Luk.
“El chip impulsa el gran avance hacia la medicina personalizada”, añade Gutiérrez. “Podría ayudarnos a comprender el impacto de la genética en la eficacia de un tratamiento”.
El estudio fue publicado en Science Advances.
Fuente: Science Alert.