Un nuevo estudio ha revelado por primera vez la estructura molecular de los cerebros afectados por la enfermedad de Alzheimer. Los investigadores han producido modelos tridimensionales de las proteínas del cerebro, incluidas dos proteínas en particular que están asociadas con la enfermedad de Alzheimer: beta-amiloide y tau.
Mientras los científicos continúan trabajando en tratamientos para la enfermedad neurodegenerativa, es importante comprender todo lo que podamos sobre ella. Los grupos de estas proteínas en el cerebro son una causa de la enfermedad de Alzheimer o una consecuencia de ella (aún no estamos muy seguros de cuál de ellas) y gracias a un equipo de la Universidad de Leeds en el Reino Unido, ahora tenemos una visión muy detallada de cómo están organizadas, hasta los detalles más minúsculos y microscópicos.
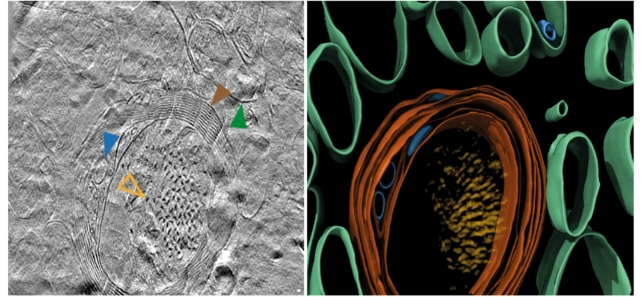
“Este primer vistazo a la estructura de las moléculas dentro del cerebro humano ofrece más pistas sobre lo que sucede con las proteínas en la enfermedad de Alzheimer”, dice el neurocientífico René Frank de la Universidad de Leeds.
“Pero también establece un enfoque experimental que se puede aplicar para comprender mejor una amplia gama de otras enfermedades neurológicas devastadoras”.
Los investigadores utilizaron una serie de técnicas avanzadas de obtención de imágenes para escanear el tejido cerebral post mortem de pacientes con Alzheimer, incluida la tomografía crioelectrónica (crioET), que utiliza lecturas de haces de electrones para mapear estructuras 3D de tejido inmovilizado a temperaturas muy bajas. La crioET permite obtener imágenes sin fijación química ni deshidratación que alteren la estructura del tejido biológico, lo que significa que los científicos ahora pueden reconstruir volúmenes 3D de tejido con resoluciones un millón de veces más pequeñas que un grano de arroz.
“La caracterización microscópica de amiloide en el cerebro con enfermedad de Alzheimer ha formado la base del diagnóstico y la clasificación de la enfermedad”, escriben los investigadores en su artículo publicado.
“La estructura in situ del amiloide en el cerebro humano es desconocida”.

Al observar estas proteínas tan de cerca, la esperanza es que podamos entender mejor cómo se forman los grumos y cómo afectan al cerebro. En las proteínas beta-amiloides, se encontró una mezcla de estructuras microscópicas similares a filamentos llamadas fibrillas y otras estructuras. En las proteínas tau, había grupos de filamentos en líneas rectas, aunque la disposición parece variar dependiendo de dónde estén las proteínas en el cerebro.

Aunque los grupos eran similares entre sí, había diferencias en la organización espacial, en términos de la forma en que se orientaban y retorcían los filamentos de tau, así como en el tamaño de las fibrillas de beta-amiloide. Esta es la primera vez que observamos estas proteínas con este nivel de detalle, y es demasiado pronto para decir algo sobre la importancia de lo que se ha revelado. Ahora que se ha demostrado que la técnica funciona, se puede probar en tejido de una gama más amplia de donantes de cerebro.

Esto revelará más sobre cómo se comportan estas diferentes proteínas en los diferentes puntos de la progresión del Alzheimer y, al comparar las estructuras a lo largo del tiempo, deberíamos poder ver cómo se desarrolla la enfermedad. De hecho, el equipo responsable del nuevo estudio cree que este enfoque podría ser útil para analizar las causas fundamentales de todo tipo de enfermedades neurodegenerativas, por lo que podemos esperar escuchar más sobre él en el futuro.
“Cohortes más grandes de diversos donantes de enfermedad de Alzheimer, en diferentes regiones cerebrales y en etapas más tempranas de la enfermedad de Alzheimer, pueden revelar cómo la organización espacial del amiloide de diferentes estructuras se relaciona con los perfiles neuropatológicos individuales”, escriben los investigadores.
“También será importante aplicar estos enfoques a otras enfermedades neurodegenerativas, muchas de las cuales comparten tipos de neuropatología amiloide relacionados o superpuestos”.
La investigación se ha publicado en Nature.
Fuente: Science Alert.
