Durante más de un siglo, hemos tratado al cerebro como una bulliciosa oficina en un rascacielos. Las neuronas actúan como los ejecutivos de alto nivel, enviando comunicados y tomando las decisiones cruciales. Las hormonas se encargan de la logística, manteniendo la comunicación fluida y las operaciones estables.
Pero hemos ignorado a los conserjes: la microglia.
Durante décadas, los científicos creyeron que estas células inmunitarias tenían una función simple y modesta: eliminar los desechos celulares, combatir los gérmenes invasores y mantener el camino libre para que las neuronas pudieran realizar el trabajo real. La microglia trabajaba en segundo plano, inadvertida y subestimada.
Pero un sorprendente estudio publicado en Molecular Psychiatry sugiere que hemos cometido un grave error. Resulta que el personal de limpieza controla todo el sistema de seguridad del edificio. Estos discretos “conserjes” son quienes tienen las llaves de nuestra ansiedad y compulsión, y si no se presentan a trabajar, todo nuestro cerebro se descontrola.
Los frenos del cerebro
La ansiedad es universal. A veces es útil, a veces un problema, pero, en definitiva, todos la hemos sentido alguna vez. Es inherente a la capacidad de razonar y al miedo a lo desconocido. Sin embargo, en ocasiones, la ansiedad puede convertirse en una fuerza dominante y aterradora.
Los trastornos de ansiedad se encuentran entre las afecciones de salud mental más comunes del mundo. En Estados Unidos, afectan a una de cada cinco personas. Sin embargo, aún se desconocen muchos aspectos de estos trastornos.
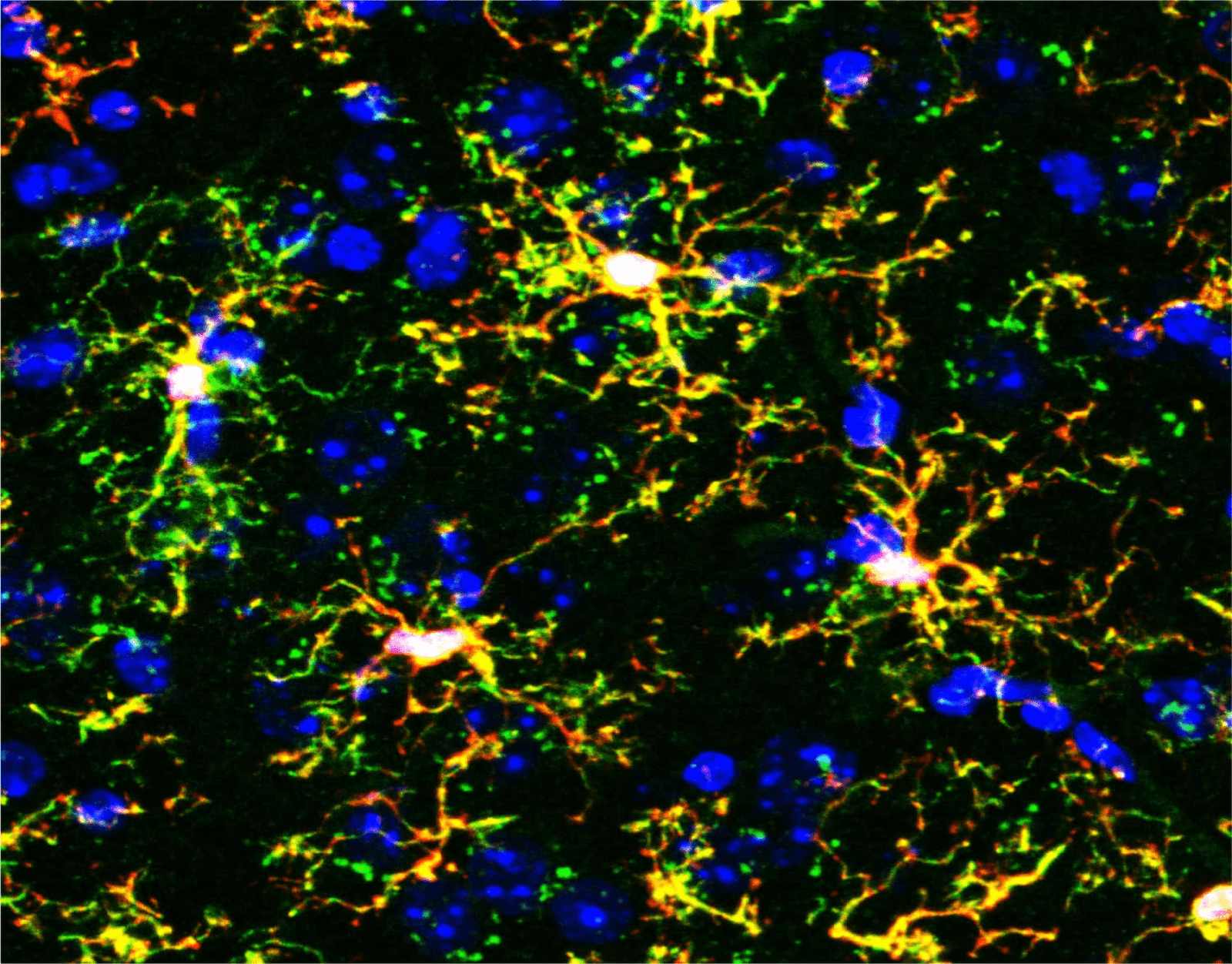
En este nuevo estudio, los investigadores analizaron los dos tipos de microglía. Primero, la microglía canónica no Hoxb8, que son las células estándar y constituyen aproximadamente el 75% de la población. Segundo, la microglía Hoxb8, que representa la minoría, constituyendo alrededor del 25% de la población. Físicamente, son casi idénticas y expresan prácticamente los mismos genes. Sin embargo, ¿funcionalmente? Son rivales acérrimos que operan en un delicado sistema binario.
El equipo sospechaba que estas dos microglías funcionan como un sistema de “acelerador/freno”. Las microglías no Hoxb8 actúan como acelerador. Su función es intensificar la ansiedad y los comportamientos de acicalamiento, posiblemente para mantener al animal alerta y limpio en un entorno peligroso. Las microglías Hoxb8, por otro lado, funcionan como freno. Su función es calmar la situación, evitando que la precaución normal se convierta en pánico y que el acicalamiento normal derive en automutilación.
Es una teoría interesante, pero ¿cómo se demuestra?
El gran intercambio de cerebros
Para comprobar la teoría fue necesaria una experimentación audaz (e invasiva). Los investigadores utilizaron ratones modificados genéticamente para carecer de microglía interna. Posteriormente, el equipo trasplantó células progenitoras purificadas —las versiones inmaduras de la microglía—. Esto les permitió crear escenarios “Frankenstein” para probar todas las variables.
Primero, trasplantaron células inmunitarias de ratones con una mutación que les provocaba la tricotilomanía a estos cerebros sanos y vacíos. El resultado fue inequívoco: los ratones receptores, que por lo demás eran genéticamente normales, comenzaron a arrancarse el pelo. Esto demostró que las células inmunitarias defectuosas eran la causa del trastorno, y no solo un síntoma.
A continuación, pusieron a prueba su teoría del “acelerador/freno”. Llenaron los cerebros vacíos exclusivamente con células “aceleradoras” (no Hoxb8), omitiendo por completo las células “frenadoras” (Hoxb8). Como se predijo, sin los frenos, los ratones desarrollaron una espiral de ansiedad elevada y acicalamiento patológico.
Finalmente, para asegurarse de que estas células trasplantadas respondieran a las señales del cerebro, el equipo implantó un interruptor genético en ellas que reaccionaba a la luz láser. Cuando los investigadores iluminaron el cerebro con un láser azul, los ratones comenzaron a acicalarse de inmediato. Esto confirmó que las células, en efecto, activaban el cerebro. En conjunto, esto confirmó esencialmente la teoría de aceleración/frenado.
“Estas dos poblaciones de microglía tienen funciones opuestas”, explica Mario Capecchi, doctor en genética humana y profesor distinguido de la Facultad de Ciencias de la Salud de la Universidad de Utah, además de autor principal del estudio. “Juntas, regulan los niveles de ansiedad en respuesta a lo que ocurre en el entorno del ratón”.
¿Por qué esto nos importa?
Por supuesto, los estudios con ratones a menudo no se pueden extrapolar directamente a los humanos. Pero es muy probable que la microglia realice tareas similares en el cerebro humano, según afirman los investigadores.
“Esto supone un cambio de paradigma”, afirma Donn Van Deren, doctor en investigación postdoctoral de la Universidad de Pensilvania, quien realizó la investigación como investigador postdoctoral en genética humana en la Universidad de Utah Health. “Demuestra que cuando el sistema inmunitario del cerebro presenta un defecto y no está sano, puede provocar trastornos neuropsiquiátricos muy específicos”.
Si los humanos compartimos este sistema binario de microglía (y dado que lo compartimos con el pez cebra, es muy probable que así sea), entonces nuestra ansiedad podría ser un problema tanto inmunológico como neurológico. Esto abre un abanico completamente nuevo de tratamientos para los trastornos de ansiedad. En lugar de intentar sedar las neuronas, los tratamientos futuros podrían centrarse en aumentar la población de microglía “frenadora” o atenuar la actividad de las células “aceleradoras”. Podríamos estar ante los albores de los tratamientos “psicoinmunológicos” para el TOC y la ansiedad. El cerebro es un lugar ruidoso, y al igual que en la vida real, hemos ignorado a los conserjes durante demasiado tiempo.
La investigación se publica en Molecular Psychiatry con el título La microglía Hoxb8 defectuosa es la causa tanto de la ansiedad crónica como del acicalamiento excesivo patológico en ratones.
Fuente: ZME Science.