El concepto de “grasas buenas” y “grasas malas” ha influido en las tendencias dietéticas, las políticas de salud pública y la investigación biomédica durante décadas. Ahora, un nuevo estudio dirigido por el Dr. Thomas A. Vallim, investigador y profesor de medicina en la División de Cardiología de la UCLA, ofrece nuevos conocimientos sobre cómo el cuerpo procesa las grasas buenas y malas a nivel molecular, lo que abre la puerta a nuevos tratamientos para la obesidad, la diabetes y otras enfermedades metabólicas. Su estudio aparece en la portada de la edición de febrero de Cell Metabolism.
“Descubrimos que si se pueden ajustar los ácidos biliares, se puede encontrar una manera de absorber selectivamente las grasas buenas y excretar las malas, con numerosos beneficios metabólicos”, afirmó el Dr. Vallim. Esto incluye la secreción de hormonas como el péptido similar al glucagón-1 (GLP-1), el mismo mecanismo que subyace a medicamentos populares para bajar de peso como Wegovy y Ozempic.
Los ácidos biliares como guardianes de la absorción de grasas
La grasa alimentaria es esencial para la supervivencia, y los humanos hemos evolucionado para procesarla con gran eficiencia. Los ácidos biliares son moléculas detergentes que ayudan a descomponer la grasa en pequeñas gotitas en el intestino, lo que permite que se absorba eficazmente en la circulación sistémica. Si bien esto era muy útil para nuestros antepasados que vivían en épocas de escasez de alimentos, esta ventaja se convierte en una desventaja en un mundo donde las opciones de alimentos ricos en grasas son fáciles de conseguir.
La dieta occidental típica es rica en grasas, especialmente grasas saturadas, que se asocian con la inflamación y suelen estar implicadas en enfermedades metabólicas. Se sabe que otros tipos de grasas, como las monoinsaturadas y las poliinsaturadas, protegen el corazón y el hígado, pero se encuentran con menos frecuencia en la dieta occidental. Este estudio, dirigido por los coautores principales Alvin P. Chan, MD, Ph.D.; Kelsey E. Jarrett, Ph.D.; y Rochelle W. Lai, MS, RD, CSP, se propuso comprender mejor cómo los ácidos biliares regulan la absorción de lípidos en las enfermedades metabólicas.
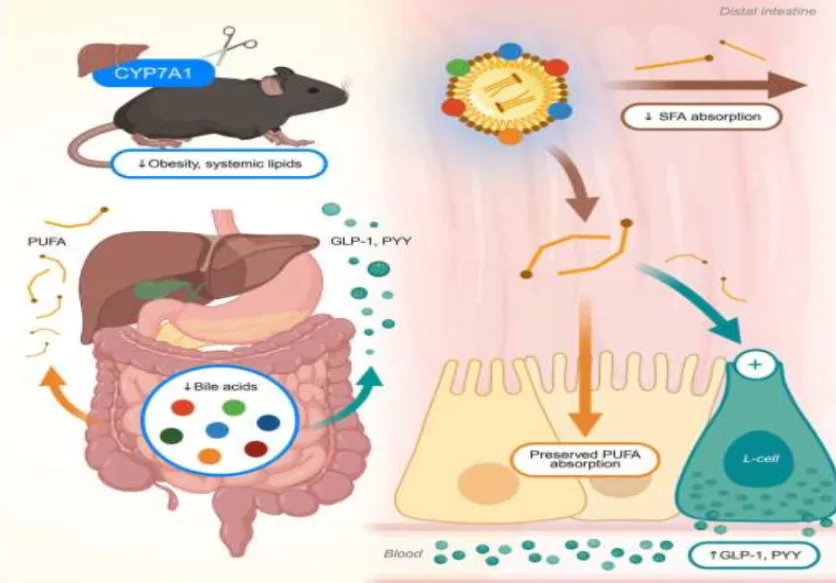
El Dr. Jarrett, científico asistente del proyecto en la División de Cardiología, diseñó una herramienta CRISPR para desactivar CYP7A1, una enzima esencial para la síntesis de ácidos biliares. Esta herramienta logró reducir los niveles de ácidos biliares en un 50% en ratones adultos.
“Utilicé algunas de las mismas técnicas de administración que se emplean en las terapias génicas humanas, pero con el fin de comprender nuevos aspectos de la biología y la nutrición”, explicó el Dr. Jarrett. “Nuestro primer objetivo fue reducir los niveles de ácidos biliares para ver si la absorción de grasa disminuía. Para ello, utilicé la edición genética en hígado de ratón adulto para inutilizar un importante gen de ácidos biliares”.
Si bien reducir los ácidos biliares para disminuir la absorción de grasas tenía sentido, Lai, dietista que cursa un doctorado en el programa de Fisiología Molecular, Celular e Integrativa de la UCLA, cuestionó si bloquear la absorción de grasas era realmente novedoso. Sugirió que un segundo grupo de ratones recibiera orlistat, un fármaco para bajar de peso aprobado por la FDA (comercializado como Alli), que bloquea la absorción de grasas mediante un mecanismo distinto al de la disminución de los ácidos biliares, para que sirviera como control positivo.
Durante ocho semanas, cada grupo de ratones recibió una dieta rica en grasas similar a la dieta occidental: una hamburguesa con queso grasienta, papas fritas y un refresco azucarado. Aunque ambos grupos absorbieron menos grasa, sólo los ratones sin CYP7A1 se protegieron del aumento de peso.
La reducción de los ácidos biliares desencadena la liberación de GLP-1
Mientras que los ratones con Cyp7a1 CRISPR consumieron la misma cantidad que los controles, el grupo tratado con orlistat consumió más. Para observar cómo ambos enfoques influyeron en la absorción, los investigadores utilizaron calorimetría con bomba de oxígeno para analizar el contenido calórico (o energético) de la materia fecal de los animales. Tanto los ratones con Cyp7a1 CRISPR como los tratados con orlistat excretaron más calorías en las heces, pero solo los ratones con Cyp7a1 CRISPR lo hicieron sin un aumento compensatorio del apetito.
El equipo se sorprendió de que los ratones sin la enzima CYP7A1 no comieran más y se preguntó si este mecanismo podría aprovecharse para reducir la obesidad. Para explorar esto más a fondo, midieron los niveles circulantes de hormonas relacionadas con la saciedad y descubrieron que la secreción de GLP-1 era notablemente mayor en los ratones sin CYP7A1 que en los que tomaban orlistat. Tras análisis adicionales que sugirieron que la liberación de GLP-1 estaba impulsada por la absorción de grasa, los investigadores examinaron en qué parte del intestino se absorbía la grasa. A diferencia de los ratones de control, los ratones con CRISPR Cyp7a1 absorbieron la grasa a mayor distancia de lo normal en el tracto digestivo.
“Creemos que lo que ocurre es que, a medida que estas grasas avanzan en el intestino, estimulan algunos receptores que promueven la secreción de GLP-1”, explicó el Dr. Vallim. “De esta manera, el cuerpo le dice al cerebro: ‘Ya he tenido suficiente de este nutriente'”.
Cómo la absorción moldea las grasas en nuestros tejidos
Tras establecer la relación entre los ácidos biliares, el apetito y la absorción de grasas, los investigadores analizaron cómo la absorción alterada de grasas modifica el metabolismo de las grasas en el hígado (el núcleo central de la distribución de la grasa) y otros tejidos. Mediante una combinación de análisis lipidómico, examen histológico y otras técnicas, descubrieron que tanto la reducción de ácidos biliares como el tratamiento con orlistat modifican los tipos de ácidos grasos que llegan a los tejidos, pero con destinos metabólicos opuestos.
En ratones CRISPR Cyp7a1, el hígado se desplazó hacia niveles más altos de grasas poliinsaturadas (buenas) y niveles más bajos de grasas saturadas (malas). En cambio, el orlistat redujo ampliamente la absorción de grasas, incluyendo las grasas poliinsaturadas beneficiosas. Como resultado, los ratones tratados con orlistat activaron las vías hepáticas que generan nuevas grasas, una respuesta que promueve la disfunción metabólica con el tiempo.
A continuación, el equipo se preguntó si los cambios en la grasa hepática se debían a la absorción de las diferentes grasas, en lugar de a que los ratones simplemente consumieran menos grasa en general. Al rastrear la absorción de ácidos grasos individuales, descubrieron que los ratones CRISPR Cyp7a1 seguían absorbiendo grasas poliinsaturadas buenas, mientras que permitían que más grasas saturadas malas pasaran a las heces, un patrón que coincidía con lo observado en los tejidos.
Identificación de los ácidos biliares
Dados los hallazgos hasta el momento, el equipo del Dr. Vallim se propuso dilucidar el mecanismo por el cual los ácidos biliares modificaban la absorción de grasas. Como moléculas de detergente, los ácidos biliares transportan los ácidos grasos envolviéndolos en partículas llamadas micelas. Los investigadores plantearon la hipótesis de que algunas grasas podrían ser más fáciles de depositar en las micelas que otras.
Para probar esta idea, extrajeron bilis de vesículas biliares de ratones y la mezclaron con ácidos grasos individuales. Los resultados confirmaron lo observado hasta el momento: las grasas saturadas requerían cantidades relativamente grandes de bilis para disolverse, mientras que los ácidos grasos insaturados requerían mucha menos. Posteriormente, los investigadores probaron la misma idea con bilis humana, cuya composición de ácidos biliares es diferente.
Utilizando la bilis de un paciente por lo demás sano tras la extirpación de la vesícula biliar, demostraron que el mecanismo era el mismo en todas las especies: los ácidos grasos saturados requerían más bilis para descomponerse que los insaturados, lo que significaba que se absorbían con menor facilidad. Cabe destacar que se necesitó mucha menos bilis humana para descomponer los ácidos grasos en comparación con los ratones, lo que sugiere que los humanos absorben la grasa con mayor facilidad.
El equipo del Dr. Vallim se propuso comprender cómo los ácidos biliares individuales contribuyen a la absorción de grasas. Para ello, utilizaron la técnica CRISPR dirigida a diferentes enzimas implicadas en la síntesis de ácidos biliares, de forma que la combinación de ácidos biliares fuera similar a la de los humanos. Tras observar los resultados, añadieron los diferentes ácidos biliares, uno a uno, para observar cómo influían en la absorción de grasas. Los resultados mostraron que no todos los ácidos biliares transportan la grasa por igual.
Cuando los investigadores eliminaron una enzima que forma un ácido biliar específico, el ácido cólico, la absorción de grasas saturadas se redujo, mientras que las grasas insaturadas continuaron absorbiéndose casi con normalidad. La reincorporación del CA a la dieta confirmó su papel clave en la absorción de grasas saturadas.
Moléculas multifacéticas, múltiples enfoques de absorción
Antes de este estudio, se creía que toda la grasa se absorbe de la misma manera mediante un proceso mayormente pasivo e inespecífico. Los resultados del equipo muestran que la absorción de grasa es mucho más selectiva de lo que se creía.
“Este estudio demuestra que los distintos tipos de grasas se absorben de forma muy distinta, y en concreto que los ácidos grasos poliinsaturados (las grasas más saludables) se absorben con mayor eficiencia en el organismo”, explicó el Dr. Chan, gastroenterólogo pediátrico y recién graduado del programa STAR de la UCLA. “Demostramos que esto se debe a los ácidos biliares y que, al manipularlos, se puede manipular la absorción”.
Así como descubrieron que no todas las grasas se absorben de la misma manera, los investigadores también demostraron que no todos los ácidos biliares son iguales.
“A menudo pensamos en los ácidos biliares como un grupo de moléculas, no como si cada uno tuviera sus propias funciones fisicoquímicas específicas”, dijo Lai. “Ver los ácidos biliares y la absorción como moléculas y procesos multifacéticos aporta una novedad a nuestro trabajo que investigaciones anteriores tal vez no habrían podido aportar”.
El equipo ahora está colaborando con otros profesores de la UCLA para diseñar pequeñas moléculas que puedan apuntar terapéuticamente a la vía de absorción de ácidos biliares y grasas para mejorar la salud metabólica.
“Creemos que existe un gran potencial en el tratamiento de este sistema y quizás de ácidos biliares específicos”, afirmó el Dr. Vallim. “Nos interesa explorar todas estas vías y, potencialmente, desarrollar nuevas terapias”.
Fuente: Medical Xpress.