El medicamento para la diabetes Ozempic ha transformado radicalmente el tratamiento para perder peso. Combinado con dieta y ejercicio, las inyecciones semanales del medicamento pueden ayudar a las personas a perder el 15% de su peso. Sin embargo, Ozempic no cambia directamente la capacidad del cuerpo para quemar grasa. Más bien, funciona en parte alterando la respuesta del cerebro a los alimentos.
Entonces, ¿cómo regula el cerebro el peso corporal?
Cada uno de nosotros tiene un peso determinado, conocido como punto de ajuste, que nuestro cerebro quiere mantener, de la misma manera que mantiene la temperatura corporal dentro de ciertos límites, dijo a Live Science el Dr. Michael Schwartz, profesor de medicina en la Universidad de Washington. A lo largo de la evolución humana, aquellos que mantuvieron su grasa corporal a un nivel constante tenían más probabilidades de sobrevivir períodos de escasez de alimentos, así como de evitar los problemas de salud que vienen con el sobrepeso, dijo.
La teoría del punto de ajuste explica por qué las dietas fracasan tan a menudo: el cerebro “quiere” mantener a las personas en un peso superior al promedio y envía señales químicas que estimulan el hambre y otras señales que dificultan la pérdida de peso. Las personas que logran perder ese peso tienen dificultades para mantenerlo a largo plazo por la misma razón.
Es el “mayor obstáculo para la pérdida de peso a largo plazo”, dijo Schwartz.
Cuando comemos, el intestino secreta hormonas y pequeños péptidos (pequeños fragmentos de proteínas) en el torrente sanguíneo, incluido el péptido similar al glucagón 1 (GLP-1), con el que Ozempic interfiere, y la grelina, que ayuda a regular el hambre. Estas sustancias químicas llegan al tronco encefálico a través del eje intestino-cerebro, una autopista de comunicación entre el intestino y el cerebro.
El tronco encefálico luego envía señales al hipotálamo, una estructura con forma de almendra en lo profundo del cerebro, que hace que las personas se sientan llenas. El hipotálamo, la región del cerebro que defiende el punto de ajuste, controla la cantidad de comida que come la gente y la grasa corporal almacenada. Detecta la hormona leptina, que se libera en proporción directa al porcentaje de tejido graso.
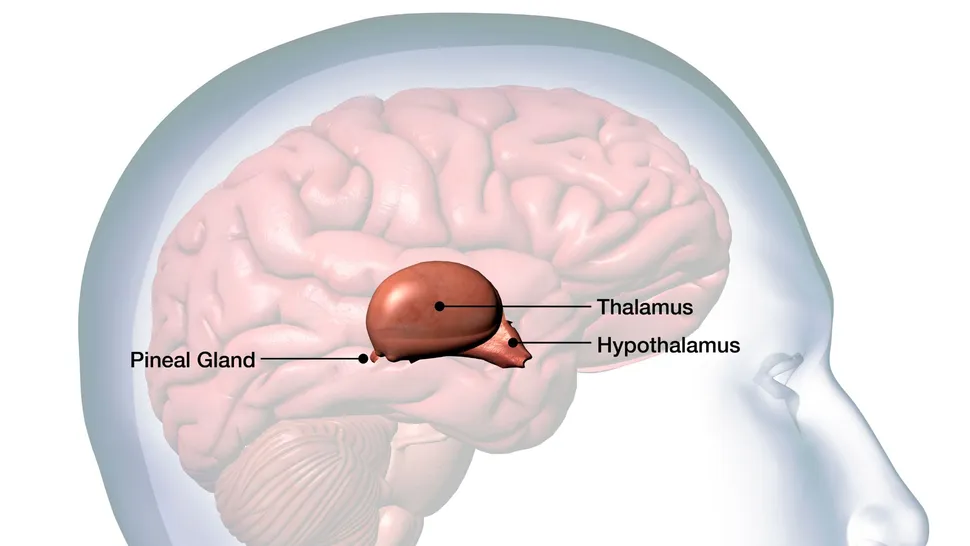
Si los niveles de leptina caen por debajo del rango dictado por el punto de ajuste, el hipotálamo envía una serie de señales al resto del cerebro, dijo Schwartz. Los cambios cerebrales resultantes hacen que la gente sienta más hambre, que la comida sea más gratificante y que se reduzca la sensibilidad al dolor, o cualquier cosa que pueda distraer a la gente de comer.
Las neuronas del hipotálamo también activan neuronas motoras que se conectan a la mandíbula, lo que da lugar a movimientos de masticación. Esta cadena de eventos depende de un circuito simple en el cerebro, que consta de tres tipos de neuronas. Si ese circuito se activa, un animal comenzará a masticar independientemente de si hay comida alrededor, según un estudio de 2024 publicado en la revista Nature. Los investigadores encontraron este circuito cerebral simple en ratones y esperan que haya algo similar en las personas.
Si el cerebro está programado para mantener un cierto peso corporal, ¿cómo se vuelve obesa la gente?
Existen hipótesis contradictorias entre los investigadores de la obesidad, pero una teoría involucra a las llamadas neuronas AgRP, un grupo de células cerebrales en el hipotálamo. Estas células juegan un papel importante en el apetito: la inhibición de las neuronas en ratones adultos hace que los animales ignoren la comida, incluso hasta el punto de morir de hambre, mientras que la estimulación de las mismas desencadena una alimentación incontrolable.
En condiciones normales, las neuronas AgRP se mantienen inactivas gracias a las hormonas y nutrientes que señalan el excedente de energía, como la leptina, la insulina y la glucosa. Curiosamente, incluso la visión de la comida es suficiente para amortiguar la actividad de las células. Pero cuando los ratones son alimentados con una dieta rica en grasas, las células de soporte llamadas glía, que rodean a las neuronas AgRP, se activan y aumentan en número. Esta respuesta, llamada gliosis, que se observa típicamente cuando las neuronas están dañadas, también se ha detectado en escáneres cerebrales de personas con obesidad.
Algunos científicos proponen que la gliosis puede impedir que las neuronas AgRP detecten las señales inhibidoras del cuerpo, las señales de “silencio”, dijo Schwartz. Cuando los investigadores muestran comida a ratones obesos, sus neuronas AgRP están entre un 50% y un 70% menos inhibidas que cuando se les presenta comida a sus compañeros de camada delgados.
Y esta sensibilidad reducida a las señales inhibidoras podría conducir a cambios dramáticos de peso. Si el hipotálamo detecta sólo la mitad de los niveles totales de leptina del cuerpo, calculará erróneamente los niveles de grasa almacenada como mucho más bajos que su punto de ajuste, lo que desencadenará señales cerebrales que aumentan los antojos y promueven el aumento de peso, explicó Schwartz.
Entonces, ¿cómo hace la semaglutida, el ingrediente activo de Ozempic y el fármaco para perder peso relacionado, Wegovy, para engañar al cerebro y hacer que pierda peso?
El fármaco imita al GLP-1. Al unirse a los receptores de GLP-1 en el tronco encefálico, estimula los circuitos neuronales que hacen que las personas se sientan llenas. Se cree que esto contrarresta la señal que induce el apetito de las neuronas AgRP, con lo que se frenan las señales del hipotálamo que provocarían un mayor apetito.
Nota del editor: este artículo se actualizó el 4 de noviembre de 2024 para incluir información sobre el circuito cerebral en ratones. El artículo original se publicó el 27 de julio de 2023.
Fuente: Live Science.