Por: Andrew Monteith
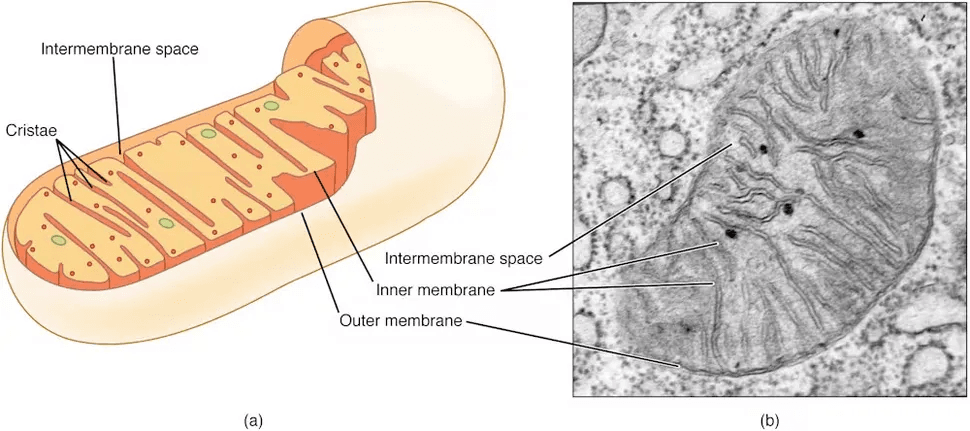
Las mitocondrias se han conocido principalmente como los componentes productores de energía de las células. Sin embargo, los científicos están descubriendo cada vez más que estos pequeños orgánulos cumplen una función mucho mayor que simplemente alimentar las células. También participan en funciones inmunitarias como el control de la inflamación, la regulación de la muerte celular y la respuesta a las infecciones.
Las investigaciones que realicé con mis colegas revelaron que las mitocondrias desempeñan otro papel clave en la respuesta inmune: detectan la actividad bacteriana y ayudan a los neutrófilos, un tipo de glóbulo blanco, a atraparlas y matarlas.
Durante los últimos 16 años, mi investigación se ha centrado en comprender las decisiones que toman las células inmunitarias durante una infección y cómo la interrupción de estos procesos causa enfermedades. Los hallazgos recientes de mi laboratorio arrojan luz sobre por qué las personas con enfermedades autoinmunitarias, como el lupus, pueden tener dificultades para combatir las infecciones, revelando un posible vínculo entre la disfunción mitocondrial y el debilitamiento de las defensas inmunitarias.
Las armas secretas del sistema inmunológico
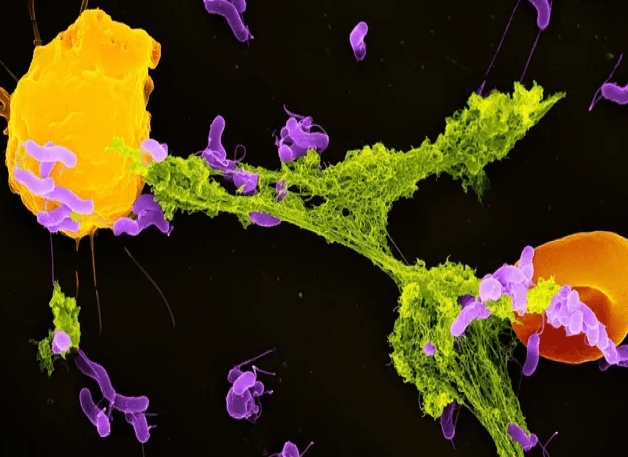
Los neutrófilos son el tipo de célula inmunitaria más abundante y actúan como primera respuesta del sistema inmunitario. Uno de sus mecanismos de defensa clave es la liberación de trampas extracelulares de neutrófilos, o NET, estructuras en forma de red compuestas de ADN y proteínas antimicrobianas. Estas NET pegajosas atrapan y neutralizan a los microbios invasores, impidiendo su propagación por el organismo.
Hasta hace poco, los científicos creían que la formación de NET se desencadenaba principalmente por el estrés y el daño celular. Sin embargo, nuestro estudio descubrió que las mitocondrias pueden detectar un subproducto bacteriano específico (el lactato) y utilizar esa señal para iniciar la formación de NET.
El lactato se asocia comúnmente con la fatiga muscular en las personas. Sin embargo, en el contexto de las infecciones bacterianas, desempeña un papel diferente. Muchas bacterias liberan lactato como parte de su propia producción de energía. Mi equipo descubrió que, una vez que las bacterias son engullidas por un compartimento celular llamado fagosoma, los neutrófilos pueden detectar la presencia de este lactato.
Dentro del fagosoma, este lactato comunica al neutrófilo la presencia de bacterias y que los procesos antibacterianos no son suficientes para eliminarlas. Cuando las mitocondrias de los neutrófilos detectan este lactato, inician la señalización para que la célula elimine las NET que han atrapado a las bacterias. Una vez que las bacterias son liberadas al exterior de la célula, otras células inmunitarias pueden eliminarlas.
Al bloquear la capacidad de las mitocondrias para detectar el lactato, los neutrófilos dejaron de producir NET de forma eficaz. Esto aumentó la probabilidad de que las bacterias escaparan a la captura y proliferaran, lo que demuestra la importancia de este mecanismo para la defensa inmunitaria. Este proceso pone de manifiesto una compleja interacción entre el metabolismo bacteriano y la maquinaria energética de la célula huésped.
Lo sorprendente de este hallazgo es que las mitocondrias de las células son capaces de detectar bacterias atrapadas en los fagosomas, a pesar de que los microbios están encerrados en un espacio separado. De alguna manera, los sensores mitocondriales pueden captar señales de estos compartimentos, una impresionante proeza de coordinación celular.
Dirigir las mitocondrias para combatir las infecciones
Nuestro estudio forma parte de un campo en expansión llamado inmunometabolismo, que explora la profunda interrelación entre el metabolismo y la función inmunitaria. En lugar de considerar el metabolismo celular estrictamente como un medio para generar energía, los investigadores ahora lo reconocen como un factor clave en las decisiones inmunitarias.
Las mitocondrias son fundamentales en esta interacción. Su capacidad para detectar, responder e incluso moldear el entorno metabólico de una célula les otorga un papel crucial a la hora de determinar cómo y cuándo se despliegan las respuestas inmunitarias.
Por ejemplo, nuestros hallazgos proporcionan una razón clave por la que los pacientes con lupus eritematoso sistémico, una enfermedad autoinmune crónica, a menudo sufren infecciones recurrentes. Las mitocondrias de los neutrófilos de los pacientes con lupus no detectan correctamente el lactato bacteriano. Como resultado, la producción de NET se redujo significativamente. Esta disfunción mitocondrial podría explicar por qué los pacientes con lupus son más vulnerables a las infecciones bacterianas, a pesar de que sus sistemas inmunitarios están constantemente activados debido a la enfermedad.
Esta observación señala el papel central de las mitocondrias en el equilibrio de la respuesta inmunitaria. Conecta dos problemas aparentemente no relacionados: la hiperactividad inmunitaria, como se observa en el lupus, y la debilidad inmunitaria, como la mayor susceptibilidad a las infecciones. Cuando las mitocondrias funcionan correctamente, ayudan a los neutrófilos a organizar un ataque eficaz y dirigido contra las bacterias. Pero cuando las mitocondrias se deterioran, este sistema se descompone.
Nuestro descubrimiento de que las mitocondrias pueden detectar el lactato bacteriano para desencadenar la formación de NET abre nuevas posibilidades para el tratamiento de infecciones. Por ejemplo, los fármacos que mejoran la detección mitocondrial podrían impulsar la producción de NET en personas con sistemas inmunitarios debilitados. Por otro lado, en afecciones donde las NET contribuyen al daño tisular, como en casos graves de COVID-19 o enfermedades autoinmunes, podría ser beneficioso limitar esta respuesta.
Además, nuestro estudio plantea la cuestión de si otras células inmunitarias utilizan mecanismos similares para detectar metabolitos microbianos y si otros subproductos bacterianos podrían actuar como señales inmunitarias. Comprender estas vías con mayor detalle podría conducir a nuevos tratamientos que modulen la respuesta inmunitaria con mayor precisión, reduciendo los daños colaterales y preservando las defensas antimicrobianas.
Las mitocondrias no son solo las centrales eléctricas de la célula, sino también las torres de vigilancia del sistema inmunitario, alertas incluso a las señales metabólicas más tenues de los invasores bacterianos. A medida que los investigadores comprenden mejor sus funciones, también crece nuestra comprensión de la complejidad y adaptabilidad de nuestras defensas celulares.
Este artículo es una traducción de otro publicado en The Conversation. Puedes leer el texto original haciendo clic aquí.