Por: Nick Norman
La tabla periódica de los elementos, creada principalmente por el químico ruso Dmitry Mendeleev (1834-1907), celebró su 150 aniversario el año pasado. Sería difícil exagerar su importancia como principio organizador de la química: todos los químicos en ciernes se familiarizan con ella desde las primeras etapas de su educación.
Dada la importancia de la tabla, se podría perdonar que se piense que el orden de los elementos ya no está sujeto a debate. Sin embargo, dos científicos de Moscú, Rusia, han publicado recientemente una propuesta para un nuevo orden.
Consideremos primero cómo se desarrolló la tabla periódica. A finales del siglo XVIII, los químicos tenían clara la diferencia entre un elemento y un compuesto: los elementos eran químicamente indivisibles (por ejemplo, hidrógeno, oxígeno) mientras que los compuestos constaban de dos o más elementos combinados, con propiedades bastante distintas de las de sus elementos componentes.
A principios del siglo XIX, había buena evidencia circunstancial de la existencia de átomos. Y en la década de 1860, era posible enumerar los elementos conocidos en orden de su masa atómica relativa; por ejemplo, el hidrógeno era 1 y el oxígeno 16.
Las listas simples, por supuesto, son unidimensionales por naturaleza. Pero los químicos eran conscientes de que ciertos elementos tenían propiedades químicas bastante similares: por ejemplo, litio, sodio y potasio o cloro, bromo y yodo.
Algo pareció repetirse y colocando elementos químicamente similares uno al lado del otro, se pudo construir una mesa bidimensional. Nació la tabla periódica. Es importante destacar que la tabla periódica de Mendeleev se había derivado empíricamente basándose en las similitudes químicas observadas de ciertos elementos. No sería hasta principios del siglo XX, después de que se hubiera establecido la estructura del átomo y siguiendo el desarrollo de la teoría cuántica, que surgiría una comprensión teórica de su estructura.
Los elementos ahora estaban ordenados por número atómico (el número de partículas cargadas positivamente llamadas protones en el núcleo atómico), en lugar de por masa atómica, pero también por similitudes químicas.
Pero este último se deriva ahora de la disposición de los electrones que se repiten en las llamadas “capas” a intervalos regulares. En la década de 1940, la mayoría de los libros de texto presentaban una tabla periódica similar a las que vemos hoy, como se muestra en la siguiente figura.
Sería comprensible pensar que este sería el fin del asunto. Sin embargo, no es así. Una simple búsqueda en Internet revelará todo tipo de versiones de la tabla periódica.
Existen versiones cortas, versiones largas, versiones circulares, versiones en espiral e incluso versiones tridimensionales. Muchos de estos, sin duda, son simplemente diferentes formas de transmitir la misma información, pero continúan existiendo desacuerdos sobre dónde deben colocarse algunos elementos.
La ubicación precisa de ciertos elementos depende de las propiedades particulares que deseamos resaltar. Por tanto, una tabla periódica que da primacía a la estructura electrónica de los átomos diferirá de las tablas en las que el criterio principal son determinadas propiedades químicas o físicas.
Estas versiones no difieren mucho, pero hay ciertos elementos – hidrógeno por ejemplo – que se pueden ubicar de manera muy diferente según la propiedad particular que se desee resaltar. Algunas tablas colocan al hidrógeno en el grupo 1, mientras que en otras se ubica en la parte superior del grupo 17; algunas mesas incluso lo tienen en un grupo por sí solo.
Sin embargo, de manera más radical, también podemos considerar ordenar los elementos de una manera muy diferente, una que no implique un número atómico o refleje una estructura electrónica, volviendo a una lista unidimensional.
Nueva propuesta
El último intento de ordenar los elementos de esta manera fue publicado recientemente en el Journal of Physical Chemistry por los científicos Zahed Allahyari y Artem Oganov.

Su enfoque, basado en el trabajo anterior de otros, es asignar a cada elemento lo que se llama un Número de Mendeleev (MN).
Hay varias formas de derivar tales números, pero el último estudio utiliza una combinación de dos cantidades fundamentales que se pueden medir directamente: el radio atómico de un elemento y una propiedad llamada electronegatividad que describe la fuerza con la que un átomo atrae electrones hacia sí mismo.
Si uno ordena los elementos por su MN, los vecinos más cercanos tienen, como era de esperar, MN bastante similares. Pero es más útil dar un paso más y construir una cuadrícula bidimensional basada en el MN de los elementos constituyentes en los llamados “compuestos binarios”.
Estos son compuestos compuestos por dos elementos, como cloruro de sodio, NaCl.
¿Cuál es el beneficio de este enfoque? Es importante destacar que puede ayudar a predecir las propiedades de compuestos binarios que aún no se han elaborado. Esto es útil en la búsqueda de nuevos materiales que probablemente sean necesarios tanto para tecnologías futuras como existentes. Con el tiempo, sin duda, esto se extenderá a compuestos con más de dos componentes elementales.
Un buen ejemplo de la importancia de la búsqueda de nuevos materiales se puede apreciar al considerar la tabla periódica que se muestra en la figura siguiente.
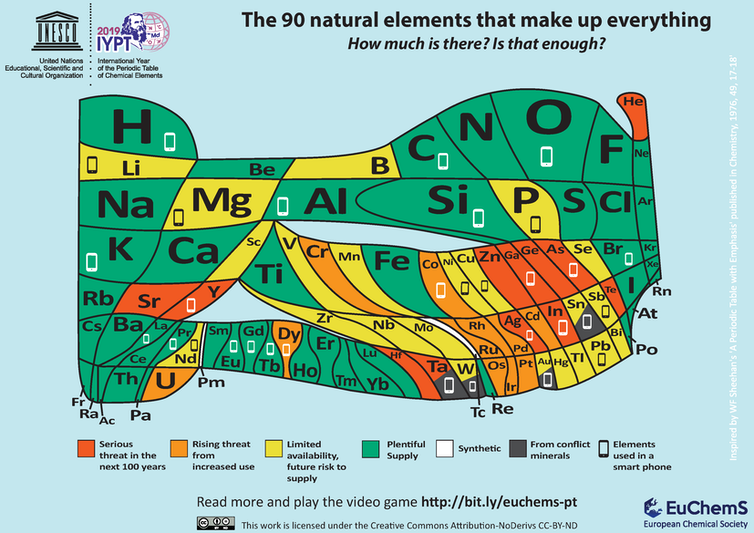
Esta tabla ilustra no solo la abundancia relativa de los elementos (cuanto más grande es la caja para cada elemento, más hay), sino que también destaca los posibles problemas de suministro relevantes para las tecnologías que se han vuelto omnipresentes y esenciales en nuestra vida diaria.
Tomemos los teléfonos móviles, por ejemplo. Todos los elementos utilizados en su fabricación se identifican con el icono del teléfono y se puede ver que varios elementos necesarios se están volviendo escasos, su suministro futuro es incierto.
Si vamos a desarrollar materiales de reemplazo que eviten el uso de ciertos elementos, los conocimientos adquiridos al ordenar los elementos por su MN pueden resultar valiosos en esa búsqueda.
Después de 150 años, podemos ver que las tablas periódicas no son solo una herramienta educativa vital, siguen siendo útiles para los investigadores en su búsqueda de nuevos materiales esenciales. Pero no debemos pensar en las nuevas versiones como reemplazos de representaciones anteriores. Tener muchas tablas y listas diferentes solo sirve para profundizar nuestra comprensión de cómo se comportan los elementos.
Este artículo es una traducción de otro publicado en The Conversation. Puedes leer el texto original haciendo clic aquí.



