Investigadores de la Academia de Ciencias de China en Beijing informaron recientemente sobre nuevas e intrigantes evidencias de un posible origen de ratón de la variante Ómicron. Su artículo, publicado en el servidor de preimpresión BioRxiv, fue rápidamente recogido y publicado unos días después por el Journal of Genetics and Genomics, y desafía la teoría predominante que afirma que la secuencia de picos polimutantes de Omicron debe haber evolucionado bajo una infección prolongada en un paciente gravemente inmunodeprimido.
Su idea principal es que un ratón podría haber sido infectado de alguna manera con el virus humano por “transferencia zoonótica inversa”, después de lo cual el virus evolucionó todas o muchas de sus 45 nuevas mutaciones, y luego se transfirió de nuevo a los humanos. Si bien esta teoría podría explicar por qué Ómicron parece tan anómalo cuando se representa en un árbol filogenético contra los sospechosos habituales, existe un problema importante: el homólogo de ratón del receptor ACE2 humano (hACE2), que el virus normalmente usa para ingresar a las células, tiene poca afinidad por la proteína de pico SARS-CoV-2 de emisión estándar.
Tan poco, de hecho, que para estudiar el virus en este animal de investigación preferido, los científicos deben introducir artificialmente hACE2 para crear ratones que muestren cualquier dificultad respiratoria significativa tras la infección. Estos ratones transgénicos se fabrican de varias formas, cada una de las cuales muestra tropismos tisulares únicos, penetrancia y efectos correspondientemente diferentes. Los investigadores han realizado experimentos knock-in en los que la secuencia de hACE2 humana se integra en el genoma del huésped y se induce bajo el control de varios promotores diferentes. Los adenovirus también se pueden usar para infectar células y crear plásmidos replicantes que propagan el código hACE2.
Teniendo en cuenta estos asuntos, ¿cómo pudo haberse arraigado en ratones el problema estándar del virus humano? Varias cosas son evidentes con respecto a cómo la secuencia de Ómicron y las secuelas de la enfermedad difieren de las de las otras cuatro variantes nombradas caballero. Si bien Ómicron parece ser más transmisible, también parece ser menos severa; no parece apuntar a diferentes clases de células en el pulmón profundo de la misma manera. Estos tipos de células pueden incluir células epiteliales bronquiolares y alveolares, macrófagos alveolares y neumocitos designados de diversas formas. Una posible explicación aquí es que Ómicron no se basa en la recepción de ACE2 y la posterior escisión de TMPRSS para la infección. En cambio, parece preferir la captación endosómica directa y la escisión por las enzimas catepsina.
Los autores razonaron que si, de hecho, Ómicron evolucionó en un ratón, entonces los detalles específicos de las 45 mutaciones que adquirió allí deberían reflejar esto directamente. En otras palabras, dado que cada organismo tiene diferentes mecanismos de reparación del ADN, abundancia de nucleótidos, preferencias de codones, antecedentes oxidativos y otras tendencias mutacionales, entonces el “espectro molecular” de sus mutaciones debería revelar una firma específica de especie. En la práctica, esto es una tarea difícil. No obstante, los investigadores construyeron razonablemente este espectro utilizando las abundancias relativas de cada una de las 12 posibles sustituciones de pares de bases (es decir, A> C, T o G, C> A, T o G, etc.) durante la evolución de Ómicron, B.1.1.529 de su antepasado más cercano.
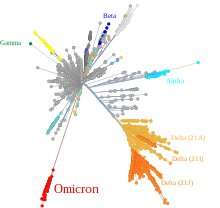
Descubrieron que el espectro mutacional molecular de Ómicron era significativamente diferente del de todos los demás virus que evolucionaron en pacientes humanos, pero se parecía mucho a los espectros asociados con la evolución del virus en células de ratón. Mientras que otros han sugerido recientemente que Ómicron podría haberse originado después de una breve incursión en un huésped intermedio como una rata, o incluso un ciervo, este estudio es el primero en poner carne real en los huesos de este tipo de zoonótico de dos pasos. Los autores sugieren que las mutaciones observadas, así como las inserciones y deleciones, podrían ser consistentes con la evolución en ratones en el transcurso de aproximadamente un año. Sin embargo, estimar tiempos de demora mutacionales como este es notoriamente difícil y, a menudo, un poco subjetivo.
Varias de estas mutaciones y los accesorios virales asociados que proporcionan son bastante curiosos. Por ejemplo, la inserción todavía inexplicable de un sitio de división de furina en el SARS-CoV-2 ha ganado una arginina clave adicional en Omicron, una modificación que parece mejorar aún más el procesamiento de furina durante el ciclo de vida viral. Sin embargo, una avalancha de nuevas investigaciones ahora sugiere que desarrollar un sitio de división de furina de la nada puede no ser tan difícil como se pensaba anteriormente. Hasta ese momento, se demostró que un murciélago europeo tiene un coronavirus que está a solo una mutación de poseer un sitio de división de furina polibásico en la ubicación del pico S1 / S2. Otras características de Omicron incluyen el escape de los tratamientos con vacunas y anticuerpos, pero no de las respuestas de las células T. La formación de sincitios por fusión celular desenfrenada, por otro lado, no se observa en Omicron, lo que potencialmente puede explicar por qué es menos grave.
Si Ómicron cambió al ratón, ¿qué tipo de ratón era? Es decir, ¿era un ratón salvaje o un ratón de laboratorio? Si es lo último, ¿un ratón completo o sólo células de un ratón? Ya en 2007, los investigadores demostraron que podían adaptar completamente el SARS-CoV-1 humano para infectar fatalmente ratones y causar estragos respiratorios después de 15 pases del virus a través de animales sucesivos. Ralph Baric y otros hicieron esto recientemente en solo 10 pasajes para el SARS-CoV-2. Este tipo de manipulaciones obviamente aceleran varias veces la evolución que ocurriría en un entorno natural. Precisamente por eso se hace. En cultivos celulares, las cosas se pueden hacer aún más rápido. Los mismos tipos de espectros de mutación molecular reveladores estudiados en Omicron como se señaló anteriormente también pueden ser evidentes después de pasar en líneas celulares específicas. En otras palabras, las características de los virus pueden evolucionar fácilmente en condiciones de cultivo específicas de acuerdo con las necesidades y tendencias de las líneas celulares específicas utilizadas.
Por ejemplo, la infección de la variante delta en células Calu-3 (células epiteliales de adenocarcinoma de pulmón humano), que tienen una alta expresión de TMPRSS y favorecen una ruta de infección de la superficie celular, fue cuatro veces mayor que la infección por Ómicron. En las células HEK (células renales embrionarias humanas) optimizadas para la entrada endosomal, por otro lado, la infección por Ómicron fue 10 veces mayor que la delta. Cuando se agregan a la mezcla líneas de células transgénicas con potencial híbrido que expresa receptores de diferentes especies, puede resultar muy difícil saber qué esperar.
Fuente: Medical Xpress.