A medida que las bacterias resistentes a los antibióticos se vuelven cada vez más difíciles de vencer, consultar a aquellos que han estado en la batalla contra nuestro antiguo enemigo mucho antes que nosotros tiene mucho sentido. Los virus llamados bacteriófagos han estado chocando con las bacterias desde mucho antes de que existiéramos. Entonces, los investigadores de la Universidad de California en San Diego observaron más de cerca algunos de los fagos gigantes menos estudiados, específicamente 201phi2-1, que infecta a la bacteria Pseudomonas chlororaphis.
Llamados así por sus grandes genomas de más de 200 000 pares de bases (la mayoría de los fagos que infectan a Pseudomonas tienen genomas de menos de 100 000 pares de bases), los jumbófagos tienen un arsenal de técnicas para contrarrestar los mecanismos de defensa bacterianos. La investigación anterior descubrió que una de estas tácticas era crear un escudo alrededor de su material genético, lo que hace que el ciclo de vida de estos virus sea único.
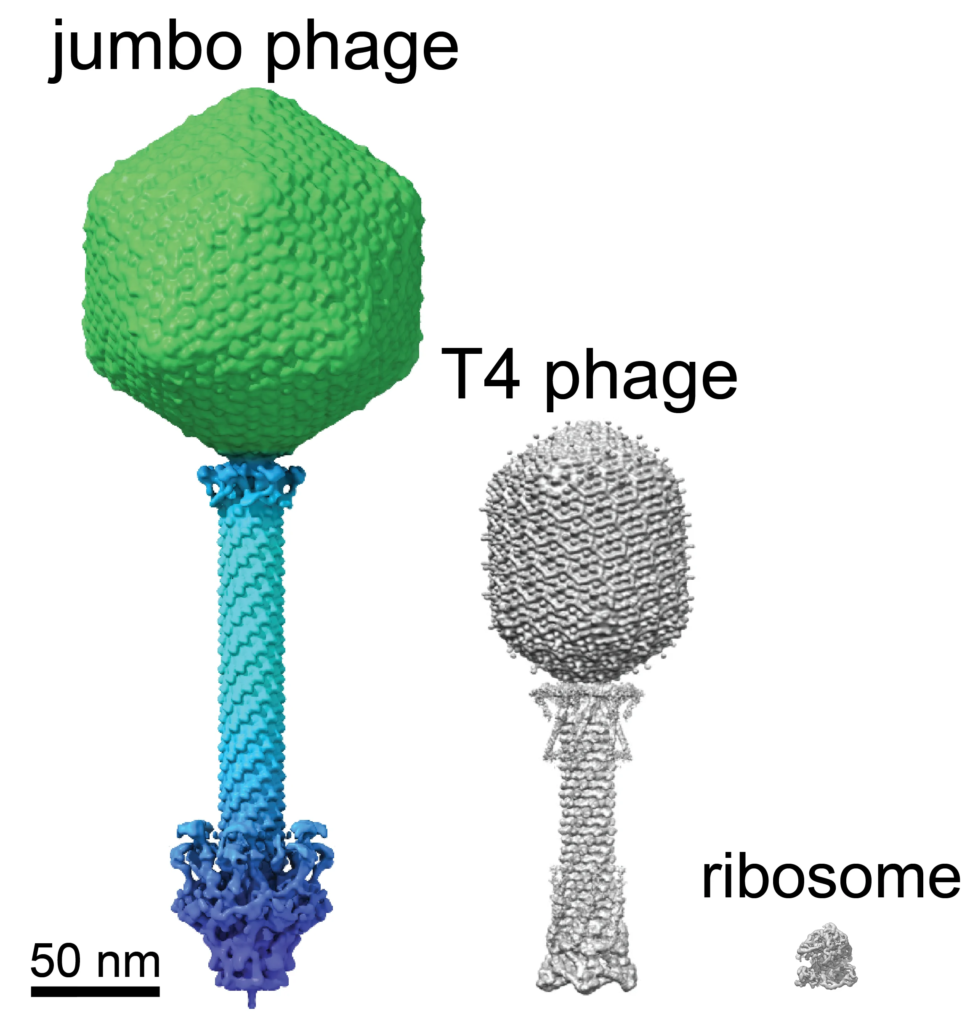
La separación del material genómico del resto del contenido celular encerrándolo “antes se pensaba que había evolucionado solo una vez en la historia de la vida”, escriben el biólogo molecular Thomas Laughlin y sus colegas en su nuevo artículo. Pero resulta que estos pequeños gigantes se nos adelantaron.
“Es un tipo diferente de compartimento, diferente a todo lo que hemos visto en la naturaleza”, dice la biofísica Elizabeth Villa.
Por lo general, los fagos inyectan su material genético en la bacteria donde flota libremente en la sustancia viscosa interna de la célula (citoplasma) mientras el virus secuestra el equipo de la bacteria para replicarse. Pero estos fagos gigantes construyen un compartimento de separación alrededor de su ADN poco después de que ingresa a su huésped, un poco como nuestras células tienen un núcleo para proteger nuestro ADN.
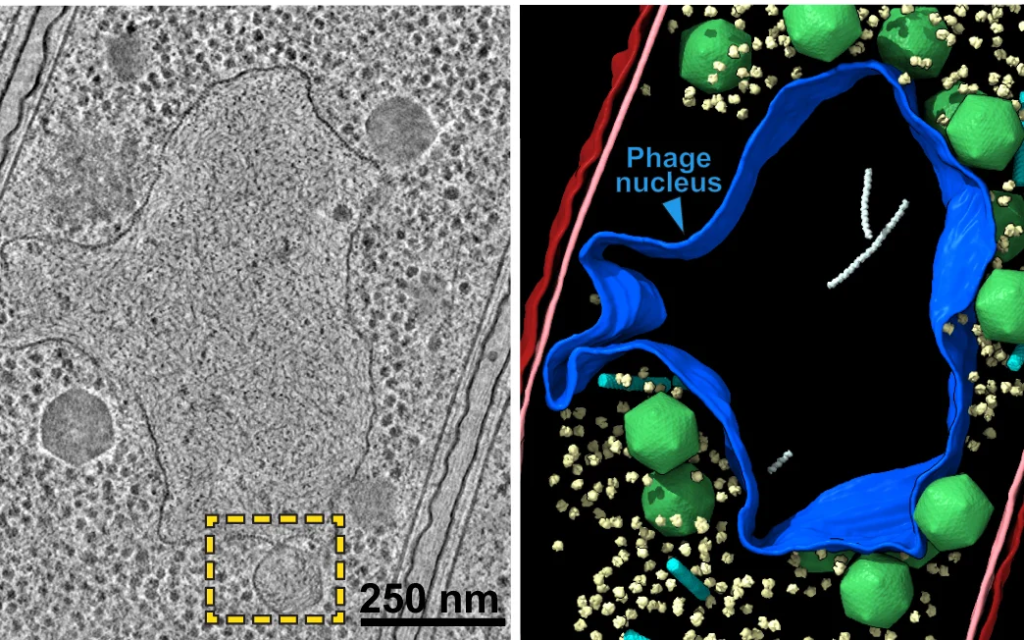
Esto impide físicamente que el ‘sistema inmunitario’ CRISPR de la bacteria (sí, son los mismos sistemas que los humanos hemos elegido para nuestros propios fines de manipulación genética) y otras enzimas defensivas interfieran con el ADN viral. Laughlin y su equipo utilizaron microscopía crioelectrónica y tomografía para examinar este compartimento hasta la escala atómica. La cubierta protectora se construyó a partir de un solo tipo de proteína, que los investigadores llamaron chimalina, en honor a un antiguo escudo azteca. Con la ayuda de modelos informáticos, los investigadores descubrieron que el núcleo del fago permite que las moléculas pasen selectivamente a través de pequeños poros, de nuevo similar a cómo las células controlan el entorno alrededor de nuestro material genético, lo que lo convierte en un ejemplo notable de evolución convergente, cuando organismos completamente no relacionados terminan con una solución similar al mismo problema biológico.
“El poro nuclear en los eucariotas es una estructura gigantesca y compleja con formas muy distintivas de mantener fuera la mayoría de las proteínas pero importando específicamente otras. Lo que probablemente estamos viendo con el jumbófago es un método dramáticamente más simple para resolver el mismo problema”, explica el bioquímico Kevin Corbett. “Es una solución sorprendentemente creativa, similar pero más simple, para proteger su genoma del mundo exterior mediante la construcción de un muro para separarlo de las defensas bacterianas”.
Increíblemente, este escudo también puede crecer a medida que se replica el genoma del fago. Los investigadores aún no están muy seguros de cómo los fagos manejan esto, pero sospechan que el compartimento probablemente se está abriendo para permitir que se unan más unidades de chimalina, que se producen en abundancia en la infección.
“Ahora que sabemos que ciertos fagos tienen un escudo, podríamos dárselo a otros fagos y hacer ‘súper fagos’ que son mejores en la terapia con fagos y en la superación de las defensas bacterianas”, dice el biólogo celular Joe Pogliano.
“El primer paso en ese proceso es comprender la estructura de la proteína chimalina que forma el escudo, que es una de las razones por las que este trabajo es tan importante”.
La terapia con fagos ya se está utilizando para tratar con éxito a pacientes con infecciones por superbacterias. También se está considerando para personalizar nuestros microbiomas cuando se descontrolan.
Con estas molestas cepas de bacterias que se niegan a morir, se espera que maten a 10 millones de personas anualmente para 2050. Por lo tanto, cualquier pista que podamos obtener del enemigo de nuestro enemigo para defendernos mejor, no puede llegar lo suficientemente pronto.
Esta investigación fue publicada en Nature.
Fuente: Science Alert.

