En 1896, el químico alemán Emil Fischer observó algo muy extraño sobre una molécula llamada acetaldehído fenilhidrazona. Lotes idénticos de este compuesto cristalino parecían tener puntos de fusión muy diferentes. Encontró que algunos lotes se fundían a temperaturas de alrededor de 65°C. Otros, a 100 °C.
Era, en una palabra, completamente extraño. No se conocía ninguna otra sustancia que se comportara de esta manera. Ni debería hacerlo. Según las leyes de la termodinámica que describen la forma en que se comporta el mundo físico, un resultado así debería ser imposible.
Los científicos estaban perplejos. Se apresuraron a ver si Fischer había cometido un error. Imagina su consternación cuando pudieron replicar sus observaciones.
Más de 120 años después del descubrimiento original de Fischer, en 2019, un equipo internacional de investigadores dirigido por el químico Terry Threfall de la Universidad de Southampton en el Reino Unido finalmente encontró y publicó la respuesta. Fischer (que más tarde ganó un premio Nobel en 1902 por otros trabajos, por lo que claramente no era un charlatán) había observado algo real; pero no, como se vería más tarde, nada que pudiera romper la termodinámica.
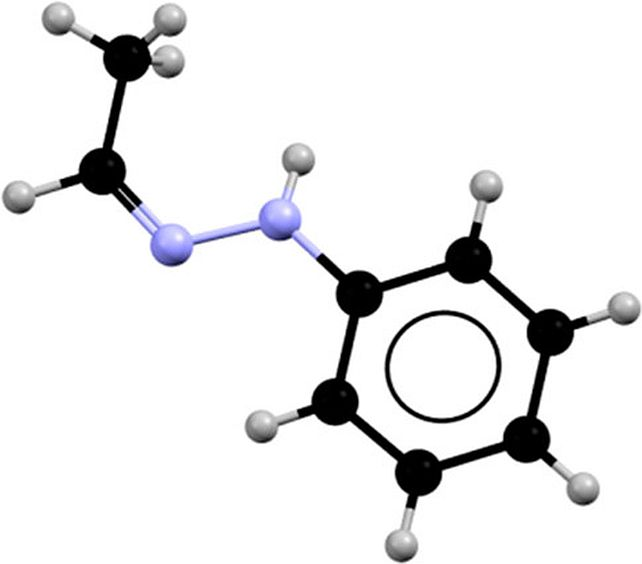
¿El culpable? Una contaminación absolutamente minúscula, tan pequeña que es casi indetectable. Cuando el acetaldehído fenilhidrazona se funde, se convierte en uno de dos líquidos, en función de si el compuesto ha sido expuesto a una base o a un ácido. El primero aparece en el punto de fusión más alto; y el segundo en el más bajo.
“Es sumamente satisfactorio poder entender un rompecabezas tan antiguo, especialmente uno que desconcertó a un científico tan eminente que se convirtió en ganador del Premio Nobel”, dijo Threlfall.
“La observación de tal comportamiento será extremadamente rara porque depende de que las moléculas en el cristal y en el líquido tengan geometrías diferentes, lo cual es inusual. Además, depende también de que la conversión por ácido sea posible y rápida”.
El compuesto se obtiene disolviendo acetaldehído sólido y añadiendo tanto fenilhidrazina líquida como etanol acuoso, y enfriando hasta que la mezcla se congela y forma cristales sólidos. Para descubrir entonces el punto de fusión de la fenilhidrazona de acetaldehído recién formada, hay que volver a fundirla.
Aquí es donde surgieron los problemas. Para entender por qué la fenilhidrazona de acetaldehído se funde a dos temperaturas distintas, los investigadores primero investigaron su forma sólida. Pero las investigaciones más avanzadas no dieron con una respuesta.
Todos los análisis, realizados por el equipo de Threlfall y otros esfuerzos recientes, no lograron encontrar una sola diferencia entre las muestras de fenilhidrazona de acetaldehído que se fundieron a la temperatura más baja y las muestras que se fundieron a la más alta. Estas técnicas incluyeron difracción de rayos X, resonancia magnética nuclear y espectroscopia IR. Hasta donde los científicos pudieron saber, los cristales eran idénticos. El siguiente paso fue investigar el líquido en el que se convertían los cristales después de fundirse.
Y allí, los investigadores obtuvieron un resultado. Había una diferencia sutil y temporal, pero clara. Aunque los compuestos tenían la misma fórmula molecular, la estructura de la masa fundida inicial era ligeramente diferente, dependiendo de la temperatura. El compuesto contiene un grupo metilo que puede tener dos configuraciones distintas, conocidas como isómero Z e isómero E. En su fase sólida, el material está compuesto casi exclusivamente por el isómero Z.
La fase líquida más estable es una mezcla de aproximadamente un tercio de isómero Z y dos tercios de isómero E. El punto de fusión más bajo de los dos produce inmediatamente la mezcla Z y E, mientras que el punto de fusión más alto es completamente Z, antes de cambiar a la parte E.
Una pista se dio en un artículo de 1905, que señalaba que el acetaldehído fenilhidrazona era extremadamente sensible al ácido. Threlfall y su equipo intentaron exponer sus muestras a vapores de ácido y amoníaco. Y descubrieron que la exposición a solo una pequeña cantidad de uno u otro podía influir de manera confiable en el punto de fusión del compuesto. El ácido actúa como catalizador para acelerar el cambio del isómero Z al E, lo que reduce el punto de fusión en el proceso.
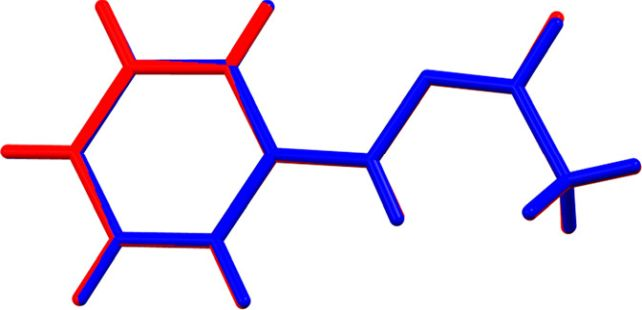
“Si un elemento o compuesto puede existir en dos o más formas cristalinas distintas, entonces cada forma tendrá energías de Gibbs diferentes y se fundirá a su propia temperatura distinta”, dijo el químico Simon Coles de la Universidad de Southampton.
“En este caso, las moléculas del cristal tienen una geometría cis (grupos que se dirigen entre sí) y se funden en una geometría idéntica en ausencia de ácido a 100°C. Sin embargo, en presencia de incluso un rastro de ácido, las moléculas se convierten al fundirse en una geometría trans (grupos que se dirigen entre sí). Este líquido tiene una energía de Gibbs menor y es más estable, por lo que el punto de fusión se convierte en 65°C”.
Es similar al efecto que tiene la sal sobre el agua: agregar sal a una olla con agua aumenta los puntos de congelación y ebullición. Mientras que se necesita mucha sal para provocar un cambio significativo en las transiciones de fase del agua, se necesita tan poco ácido para alterar la fenilhidrazona de acetaldehído que se tardó más de un siglo (y Threlfall y sus colegas una década) en descubrirlo.
Esta investigación es un verdadero testimonio de la curiosidad y la tenacidad humanas. Y nos da esperanza para el futuro. ¿Cuántos misterios más se resolverán en los años que se extienden hacia un futuro brillante de descubrimientos?
La investigación fue publicada en 2019 en Crystal Growth & Design.
Fuente: Science Alert.