Cada año, 12 millones de personas en todo el mundo sufren un ictus; muchas fallecen o quedan con secuelas permanentes. Actualmente, se administran fármacos para disolver el trombo que obstruye el vaso sanguíneo. Estos fármacos se distribuyen por todo el cuerpo, lo que significa que se debe administrar una dosis elevada para asegurar que la cantidad necesaria llegue al trombo. Esto puede provocar efectos secundarios graves, como hemorragias internas.
Dado que los medicamentos a menudo solo son necesarios en áreas específicas del cuerpo, la investigación médica lleva mucho tiempo buscando una manera de utilizar microrobots para administrar fármacos donde se necesitan: en el caso de un accidente cerebrovascular, directamente al trombo relacionado con el accidente cerebrovascular.
Un equipo de investigadores de la ETH de Zúrich ha logrado importantes avances en varios niveles. Han publicado sus hallazgos en Science.
Se requieren nanopartículas de precisión
El microrrobot que utilizan los investigadores consta de una cápsula esférica patentada, hecha de una cubierta de gel soluble, que pueden controlar con imanes y guiar a través del cuerpo hasta su destino. Las nanopartículas de óxido de hierro en la cápsula proporcionan las propiedades magnéticas.
“Debido al pequeño tamaño de los vasos sanguíneos del cerebro humano, existe un límite en el tamaño que puede tener la cápsula. El desafío técnico consiste en garantizar que una cápsula tan pequeña también tenga propiedades magnéticas suficientes”, explica Fabian Landers, autor principal del artículo e investigador postdoctoral en el Laboratorio de Robótica Multiescala de la ETH de Zúrich.
El microrrobot también necesita un agente de contraste para que los médicos puedan observar mediante rayos X su movimiento a través de los vasos sanguíneos. Los investigadores se centraron en nanopartículas de tantalio, que se utilizan comúnmente en medicina, pero son más difíciles de controlar debido a su mayor densidad y peso.
“Combinar la funcionalidad magnética, la visibilidad de imágenes y el control preciso en un solo microrobot requirió una sinergia perfecta entre la ciencia de materiales y la ingeniería robótica, algo que nos ha llevado muchos años lograr con éxito”, afirma el profesor Bradley Nelson de la ETH, que lleva décadas investigando microrrobots.
El profesor Salvador Pané, químico del Instituto de Robótica y Sistemas Inteligentes, y su equipo desarrollaron nanopartículas de óxido de hierro de precisión que permiten este delicado equilibrio.
Un catéter especial libera una cápsula cargada con fármaco.
Los microrrobots también contienen el ingrediente activo que deben administrar. Los investigadores lograron cargar con éxito los microrrobots con fármacos comunes para diversas aplicaciones; en este caso, un agente trombolítico, un antibiótico o un medicamento antitumoral. Estos fármacos fueron liberados por un campo magnético de alta frecuencia que calienta las nanopartículas magnéticas, disolviendo la cubierta de gel y el microrrobot.
Los investigadores emplearon una estrategia en dos pasos para acercar el microrrobot a su objetivo: primero, lo inyectaron en la sangre o el líquido cefalorraquídeo mediante un catéter. Posteriormente, utilizaron un sistema de navegación electromagnética para guiar el microrrobot magnético hasta la ubicación objetivo.
El diseño del catéter se basa en un modelo comercial con una guía interna conectada a una pinza de polímero flexible. Al empujarlo más allá de la guía externa, la pinza de polímero se abre y libera el microrobot.
Nadar contra la corriente: navegar por los vasos sanguíneos
Para dirigir con precisión los microrobots, los investigadores desarrollaron un sistema de navegación electromagnética modular adecuado para su uso en el quirófano.
“La velocidad del flujo sanguíneo en el sistema arterial humano varía mucho según la ubicación. Esto hace que la navegación de un microrobot sea muy compleja”, explica Nelson. Los investigadores combinaron tres estrategias diferentes de navegación magnética que les permitieron navegar por todas las regiones de las arterias de la cabeza.
Esto les permite hacer rodar la cápsula a lo largo de la pared del recipiente mediante un campo magnético rotatorio. La cápsula puede guiarse hacia su objetivo con enorme precisión a una velocidad de 4 milímetros por segundo.
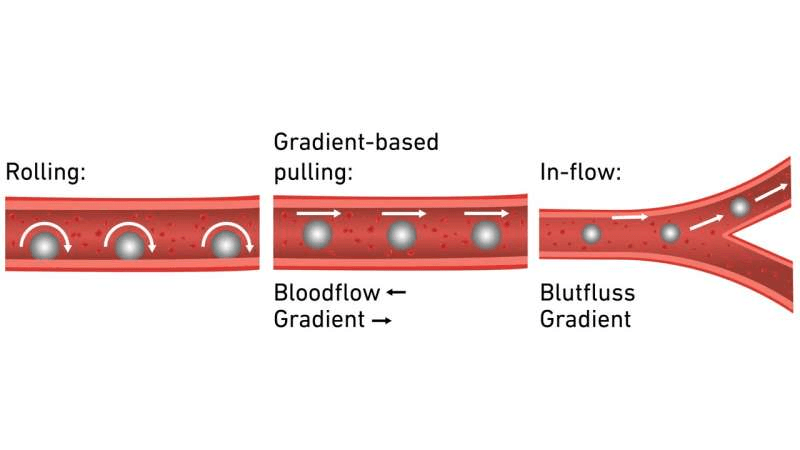
En otro modelo, la cápsula se mueve mediante un gradiente de campo magnético: el campo magnético es más intenso en un punto que en otro. Esto atrae al microrrobot dentro del recipiente hacia el campo más intenso. La cápsula puede incluso ir contracorriente, y a una velocidad de flujo considerable, superior a 20 centímetros por segundo.
“Es sorprendente la cantidad de sangre que fluye por nuestros vasos sanguíneos y a tan alta velocidad. Nuestro sistema de navegación debe ser capaz de soportar todo eso”, dice Landers.
Cuando el microrrobot llega a una bifurcación en los vasos sanguíneos que dificultaría su maniobra, entra en juego la navegación por flujo. El gradiente magnético se dirige contra la pared del vaso de tal manera que la cápsula es transportada hacia el vaso correcto.
Al integrar estas tres estrategias de navegación, los investigadores logran un control eficaz sobre los microrrobots en diversas condiciones de flujo y escenarios anatómicos. En más del 95% de los casos probados, la cápsula administró el fármaco con éxito en el lugar correcto.
“Los campos y gradientes magnéticos son ideales para procedimientos mínimamente invasivos porque penetran profundamente en el cuerpo y, al menos con las intensidades y frecuencias que utilizamos, no tienen efectos perjudiciales para el organismo”, explica Nelson.
La innovación no se detiene en la robótica
Para probar los microrobots y su navegación en un entorno realista, los investigadores desarrollaron modelos de silicona que reproducen con precisión los vasos sanguíneos de pacientes y animales. Estos modelos vasculares son tan realistas que actualmente se utilizan en la formación médica y son comercializados por Swiss Vascular, una empresa derivada de la ETH de Zúrich.
“Los modelos son cruciales para nosotros, ya que practicamos extensamente para optimizar la estrategia y sus componentes. Eso no se puede hacer con animales”, explica Pané. En el modelo, los investigadores lograron localizar y disolver un coágulo de sangre.
Tras numerosos ensayos exitosos con el modelo, el equipo buscó demostrar las capacidades del microrrobot en condiciones clínicas reales. En primer lugar, lograron demostrar en cerdos que los tres métodos de navegación funcionan y que el microrrobot permanece claramente visible durante todo el procedimiento. En segundo lugar, navegaron microrrobots a través del líquido cefalorraquídeo de una oveja.
Landers está particularmente satisfecho. “Este complejo entorno anatómico tiene un enorme potencial para futuras intervenciones terapéuticas, por lo que nos entusiasmó tanto que el microrobot pudiera desenvolverse también en este entorno”.
Aplicaciones más allá de las oclusiones vasculares
Además de tratar la trombosis, estos nuevos microrrobots también podrían utilizarse para infecciones o tumores localizados. En cada etapa de su desarrollo, el equipo de investigación se ha mantenido enfocado en su objetivo: garantizar que todo lo que creen esté listo para su uso en quirófanos lo antes posible. El próximo objetivo es comenzar los ensayos clínicos en humanos cuanto antes.
Al hablar sobre lo que motiva a todo el equipo, Landers dice: “Los médicos ya están haciendo un trabajo increíble en los hospitales. Lo que nos impulsa es saber que contamos con una tecnología que nos permite ayudar a los pacientes de forma más rápida y eficaz, y brindarles nuevas esperanzas a través de terapias innovadoras”.
Fuente: Phys.org.
