Por: Jenna Cash
Millones de personas en todo el mundo viven con heridas que simplemente no cicatrizan. Estas heridas persistentes, a menudo causadas por diabetes, mala circulación o presión, pueden ser dolorosas, propensas a infecciones y afectar gravemente la calidad de vida. En casos graves, pueden llevar a la amputación.
Los tratamientos actuales ayudan a controlar los síntomas, pero no siempre abordan el problema subyacente. Esto implica vendajes, antibióticos y visitas clínicas repetidas, a menudo durante meses o años. Para muchas personas, ese ciclo nunca termina del todo. Pero las últimas investigaciones publicadas por mis colegas y por mí ofrecen una nueva perspectiva sobre por qué algunas heridas simplemente no cicatrizan, y apuntan a una posible nueva forma de tratarlas.
Al estudiar tejido humano y modelos experimentales, descubrimos que una molécula cutánea llamada MC1R se altera constantemente en heridas crónicas. Al estimular esta molécula, la piel redujo la inflamación y reanudó su cicatrización.
El MC1R es conocido por algo muy distinto a la cicatrización de heridas: este gen es responsable del cabello pelirrojo y la piel muy clara. Pero el MC1R influye mucho más que en la pigmentación.
El MC1R se encuentra en muchos tipos diferentes de células cutáneas, incluyendo células inmunitarias, queratinocitos (las células que forman la capa externa de la piel), fibroblastos (las células que forman el tejido cicatricial) y las células que recubren los vasos sanguíneos. Esto significa que el MC1R puede influir en varias partes del proceso de cicatrización.
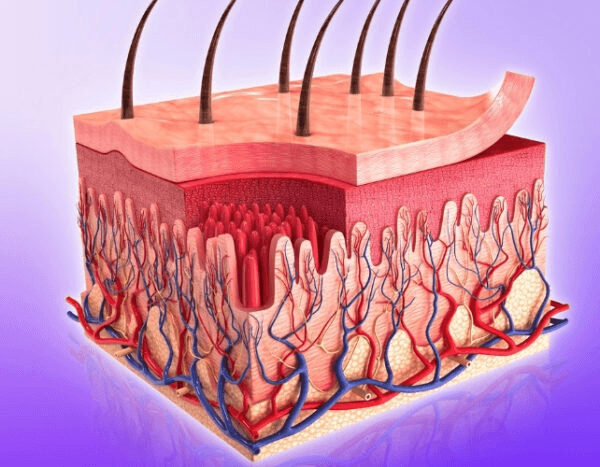
El proceso de curación es más complejo que simplemente cerrar una herida. La piel primero desencadena la inflamación (la respuesta de defensa temprana del cuerpo que elimina microbios y tejido dañado), y luego la desactiva gradualmente para permitir la reparación. Cuando esta desactivación falla, las heridas pueden permanecer inflamadas durante meses.
Dado que se sabe que el MC1R tiene funciones antiinflamatorias en otras enfermedades como la artritis, queríamos saber si su comportamiento también podría ayudar a explicar por qué las heridas crónicas no cicatrizan. Para responder a esta pregunta, utilizamos dos enfoques complementarios. Primero, analizamos muestras de tejido humano de tres tipos principales de heridas crónicas: úlceras del pie diabético, úlceras venosas de la pierna y úlceras por presión.
A pesar de tener causas diferentes, estas heridas presentaban un problema similar: el mecanismo que normalmente ayuda a calmar la inflamación estaba alterado. Tanto el MC1R como su molécula asociada natural, la POMC, también presentaban un desequilibrio, presente en todos los tipos de heridas.
En segundo lugar, utilizamos modelos experimentales para comprender cómo esta alteración afecta la cicatrización. Examinamos ratones portadores de una versión no funcional del MC1R. Estos animales desarrollaron heridas de cicatrización lenta y mostraron algunas de las mismas características que observamos en las heridas crónicas humanas.
Sus heridas contenían muchas células inmunes inflamatorias y abundantes “trampas extracelulares de neutrófilos”: redes pegajosas de ADN y proteínas que, cuando persisten, se asocian con una inflamación continua y una reparación retrasada.
Para replicar mejor las heridas crónicas humanas, también creamos un nuevo modelo murino que produce úlceras de cicatrización lenta y con alta inflamación. Esto nos permitió probar posibles tratamientos en afecciones que imitan con precisión las enfermedades humanas.
Al aplicar un fármaco tópico que activa selectivamente el MC1R, la cicatrización mejoró notablemente. Las úlceras produjeron menos exudado (el líquido que suele supurar de las heridas crónicas), aumentó el crecimiento de los vasos sanguíneos (mejorando el suministro de oxígeno y nutrientes al lecho de la herida) y la capa externa de la piel comenzó a recuperarse y cerrarse sobre la herida.
Es importante destacar que la activación de MC1R redujo las trampas extracelulares de neutrófilos y limitó la llegada de nuevas células inflamatorias. También aplicamos el fármaco a un pequeño corte en animales sanos. La estimulación del MC1R aumentó aún más el flujo sanguíneo, mejoró el drenaje linfático y redujo la cicatrización. Esto sugiere que el MC1R favorece la cicatrización no solo cuando las heridas están atascadas, sino también en condiciones normales.
En conjunto, estos hallazgos indican que el MC1R desempeña un papel fundamental en la coordinación de varios aspectos clave de la reparación de la piel. Cuando la vía se interrumpe, la inflamación persiste. Cuando el MC1R se activa, dicha inflamación puede resolverse y permitir que otros procesos de curación progresen.
Curación de heridas crónicas
Las heridas crónicas afectan a millones de personas, y las cifras están aumentando junto con las tasas mundiales de diabetes, envejecimiento y obesidad. Además, son extremadamente costosas para los sistemas de salud. Incluso pequeñas mejoras en la cicatrización podrían marcar una diferencia significativa para los pacientes y reducir la presión sobre los servicios.
Nuestros hallazgos plantean la posibilidad de nuevos tratamientos dirigidos al MC1R para ayudar a la piel a superar un estado inflamatorio crónico. Dados los efectos positivos observados con la aplicación tópica, las terapias futuras podrían consistir en ungüentos o geles que los pacientes podrían aplicar ellos mismos. Si bien se necesita más investigación, identificar a MC1R como una vía clave interrumpida en heridas crónicas nos brinda una comprensión más clara de por qué algunas heridas no cicatrizan y ofrece esperanza de encontrar nuevas formas de ayudar a la piel a repararse a sí misma.
Este artículo es una traducción de otro publicado en The Conversation. Puedes leer el texto original haciendo clic aquí.
